ВНУТРЕННЯЯ
ДИФФУЗНАЯ
ГЛИОМА МОСТА
#DIPG
Тут НЕ врачи говорят об одной из детских high-grade глиом - DIPG.
Согласно классификации ВОЗ в 2021 - это диффузная срединная глиома, diffuse midline glioma (DMG with H3K27 alteration). Также ее называют «H3K27M-мутантная», «глиома ствола головного мозга», «понтинная глиома», «диффузная (инфильтрирующая) астроцитома»
Согласно классификации ВОЗ в 2021 - это диффузная срединная глиома, diffuse midline glioma (DMG with H3K27 alteration). Также ее называют «H3K27M-мутантная», «глиома ствола головного мозга», «понтинная глиома», «диффузная (инфильтрирующая) астроцитома»
ЧТО ЭТО?!
КТО ВИНОВАТ?!
ЧТО НАМ ДЕЛАТЬ?!
ЧТО..
Диффузная срединная глиома - это тип опухоли головного мозга, происходящей из глиальных клеток в центральной нервной системе, обычно в области ствола мозга, но также может быть обнаружена в таламусе, спинном мозге и мозжечке.
ДИФФУЗНАЯ означает, что опухоль не имеет четких границ (по МРТ может иметь четкие границы, т.е. быть "локализованной") - она прорастает в другие ткани, так что раковые клетки смешиваются со здоровыми клетками.
СРЕДИННАЯ (средней линии) - это указание на расположение опухоли, то есть на среднюю линию мозга. Опухоли DMG, как правило, обнаруживаются в области моста мозга (и тогда они называются DIPG). Мост отвечает за жизненно важные функции, включая равновесие, дыхание, контроль мочевого пузыря, частоту сердечных сокращений и кровяное давление. Также через эту область мозга проходят нервы, контролирующие зрение, слух, речь, глотание и движение.
ГЛИОМА - это общий термин для обозначения опухолей, происходящих из глиальных клеток. Глиальные клетки встречаются во всем мозге. Они составляют белое вещество мозга, которое окружает и поддерживает нейроны (нейроны - это клетки, которые передают сообщения в мозге).
ДИФФУЗНАЯ означает, что опухоль не имеет четких границ (по МРТ может иметь четкие границы, т.е. быть "локализованной") - она прорастает в другие ткани, так что раковые клетки смешиваются со здоровыми клетками.
СРЕДИННАЯ (средней линии) - это указание на расположение опухоли, то есть на среднюю линию мозга. Опухоли DMG, как правило, обнаруживаются в области моста мозга (и тогда они называются DIPG). Мост отвечает за жизненно важные функции, включая равновесие, дыхание, контроль мочевого пузыря, частоту сердечных сокращений и кровяное давление. Также через эту область мозга проходят нервы, контролирующие зрение, слух, речь, глотание и движение.
ГЛИОМА - это общий термин для обозначения опухолей, происходящих из глиальных клеток. Глиальные клетки встречаются во всем мозге. Они составляют белое вещество мозга, которое окружает и поддерживает нейроны (нейроны - это клетки, которые передают сообщения в мозге).

ЦИФРЫ
медиана выживаемости
(на 2006 г.) после постановки диагноза.
С тех пор, благодаря новым видам терапии, можно говорить об увеличении продолжительности жизни
(на 2006 г.) после постановки диагноза.
С тех пор, благодаря новым видам терапии, можно говорить об увеличении продолжительности жизни
пациентов выживали через 2 года после постановки диагноза
(на 2016 г.)
(на 2016 г.)
8-11 мес.
10%
пациентов выживали через 5 лет после постановки диагноза
(на 2016 г.)
(на 2016 г.)
человек населения в год
получает данный диагноз.
получает данный диагноз.
2%
один из миллиона
ПОЧЕМУ..
Исследователи всё ещё не знают, что вызывает DMG/DIPG. Как и большинство раковых заболеваний, DMG/DIPG возникает, когда что-то идет не так в процессе размножения клеток. Однако, в отличие от многих других видов рака, нет никаких доказательств того, что DMG/DIPG вызывается факторами окружающей среды (воздействием химических веществ или радиации) или особыми наследственными генетическими вариациями.
Клетки используют ДНК - строительные блоки генов - для выполнения различных функций, в том числе для создания новых клеток. Иногда фрагменты ДНК повреждаются или неправильно копируются. Ученые называют это мутацией. Обычно клетки с мутациями в ДНК либо исправляют их, либо погибают (этот процесс называется апоптозом). Однако иногда клетки с мутациями не восстанавливаются и не умирают, как положено. В некоторых случаях эти мутировавшие клетки начинают быстро делиться, что может привести к развитию рака.
Благодаря расширению доступа к образцам опухолей через DMG Registry в США, понимание биологии DMG/DIPG значительно улучшилось за последние годы. Исследователи начали понимать, какие именно генетические мутации связаны с DMG/DIPG, благодаря использованию генетического секвенирования (тест для определения мутаций). Они обнаружили наиболее распространенные мутации, связанные с DMG/DIPG, и теперь работают над тем, чтобы лучше понять эти мутации, чтобы разработать новые лекарства или перепрофилировать уже существующие препараты, которые смогут эффективно лечить DMG/DIPG.
Клетки используют ДНК - строительные блоки генов - для выполнения различных функций, в том числе для создания новых клеток. Иногда фрагменты ДНК повреждаются или неправильно копируются. Ученые называют это мутацией. Обычно клетки с мутациями в ДНК либо исправляют их, либо погибают (этот процесс называется апоптозом). Однако иногда клетки с мутациями не восстанавливаются и не умирают, как положено. В некоторых случаях эти мутировавшие клетки начинают быстро делиться, что может привести к развитию рака.
Благодаря расширению доступа к образцам опухолей через DMG Registry в США, понимание биологии DMG/DIPG значительно улучшилось за последние годы. Исследователи начали понимать, какие именно генетические мутации связаны с DMG/DIPG, благодаря использованию генетического секвенирования (тест для определения мутаций). Они обнаружили наиболее распространенные мутации, связанные с DMG/DIPG, и теперь работают над тем, чтобы лучше понять эти мутации, чтобы разработать новые лекарства или перепрофилировать уже существующие препараты, которые смогут эффективно лечить DMG/DIPG.

ПУТЬ..
При подозрении на DMG/DIPG существует стандартный курс лечения, которого, скорее всего, будет придерживаться ваш врач:
Почти во всех случаях примерно через 6-12 месяцев после первой лучевой терапии опухоль DMG/DIPG начинает расти снова. Как только опухоль начинает расти снова, никакое дальнейшее лечение не улучшает выживаемость (но может увеличить продолжительность жизни). Когда у детей начинаются неврологические симптомы, им часто возобновляют прием стероидов.
Также лечение может включать хирургическое вмешательство, химиотерапию, различные виды иммунотерапии, прием таргетных препаратов, лечение электромагнитными полями (TTFields).
- В момент постановки диагноза пациентам с диффузной глиомой средней линии часто в первую очередь назначают стероиды (напр. дексаметазон).
- Вскоре после приема стероидов пациенты готовятся к лучевой терапии.
- К сожалению, на сегодняшний день не известно ни одного химиотерапевтического препарата (включая темозоломид), способного повлиять на выживаемость.
Почти во всех случаях примерно через 6-12 месяцев после первой лучевой терапии опухоль DMG/DIPG начинает расти снова. Как только опухоль начинает расти снова, никакое дальнейшее лечение не улучшает выживаемость (но может увеличить продолжительность жизни). Когда у детей начинаются неврологические симптомы, им часто возобновляют прием стероидов.
Также лечение может включать хирургическое вмешательство, химиотерапию, различные виды иммунотерапии, прием таргетных препаратов, лечение электромагнитными полями (TTFields).

03
Состояние
Оценивать состояние. Невзирая на все потоки информации и тяжесть сложившейся ситуации, самое главное - это текущее состояние вашего ребенка.
Оценка состояния - консультация со специалистом (либо с несколькими) - действия.
Оценка состояния - консультация со специалистом (либо с несколькими) - действия.
02
Команда
Собрать команду. Чаще всего родителям приходится самим выполнять роль координатора - искать невролога, онколога/нейроонколога, рентгенолога (описание МРТ), нейрохирурга, эндокринолога, реабилитолога, паллиативного терапевта.
Контакты врачей можно найти на этом сайте.
Контакты врачей можно найти на этом сайте.
01
Информация
Получить информацию. Ваши родственники, друзья и знакомые и будут присылать вам всевозможную информацию про лекарства от рака и контакты врачей.
К сожалению, эта информация будет вряд ли вам полезна. На www.dipg.org собраны все фактические данные. Увы, только на английском. Используйте переводчик в браузере. Часть статей переведены на этом сайте
К сожалению, эта информация будет вряд ли вам полезна. На www.dipg.org собраны все фактические данные. Увы, только на английском. Используйте переводчик в браузере. Часть статей переведены на этом сайте
Шаг за шагом
Полезные штуки

Telegram - Диффузная срединная глиома https://t.me/+wkuw3aga9j4yZGQ6
Telegram - Опухоль головного мозга у ребенка https://t.me/+QQpgKQNXLa1jNjQy
Telegram - Опухоль мозга https://t.me/+FH8p3tCyu6IwNTky
Telegram - Опухоль головного мозга у ребенка https://t.me/+QQpgKQNXLa1jNjQy
Telegram - Опухоль мозга https://t.me/+FH8p3tCyu6IwNTky

- Нейроонколог Желудкова Ольга Григорьевна (ГБУЗ «НПЦ спец.мед.помощи детям ДЗМ»)
- Нейрооколог Кумирова Элла Вячеславовна (ГБУЗ "Морозовская детская городская клиническая больница ДЗ г. Москвы)
- Нейрохирург Лившиц Матвей Игоревич (Израиль, Москва)
- Нейрохирург Кадыров Шавкат Умидович (НМИЦ нейрохирургии им. ак. Н. Н. Бурденко)
- Нейрохирург Кушель Юрий Вадимович (НМИЦ нейрохирургии им. ак. Н. Н. Бурденко)
- Онколог Левашов Андрей Сергеевич (НМИЦ онкологии им. Н.Н. Блохина, НМИЦ нейрохирургии им. ак. Н. Н. Бурденко)
- Радиолог Регентова Ольга Сергеевна (ФГБУ "РНЦРР")
- Рентгенолог Быченко Владимир (ФГБУ «НМИЦ АГП им. В.И. Кулакова»)

- Задавайте вопросы и делайте заметки
- Ходите вдвоём на важные приемы к врачу
- Сделайте биопсию
- Получите второе мнение (попытайтесь получить обратную связь от https://dipgregistry.org/)
- Не сомневайтесь в правильности своих решений
- Принимайте помощь
- Это не спринт, это марафон. Но не откладывайте развлечения на "лучшие времена"
- Сохраняйте надежду
NCCN Guidelines
Pediatric Central Nervous
System Cancers
Version 2.2025 — January 17, 2025
Pediatric Central Nervous
System Cancers
Version 2.2025 — January 17, 2025
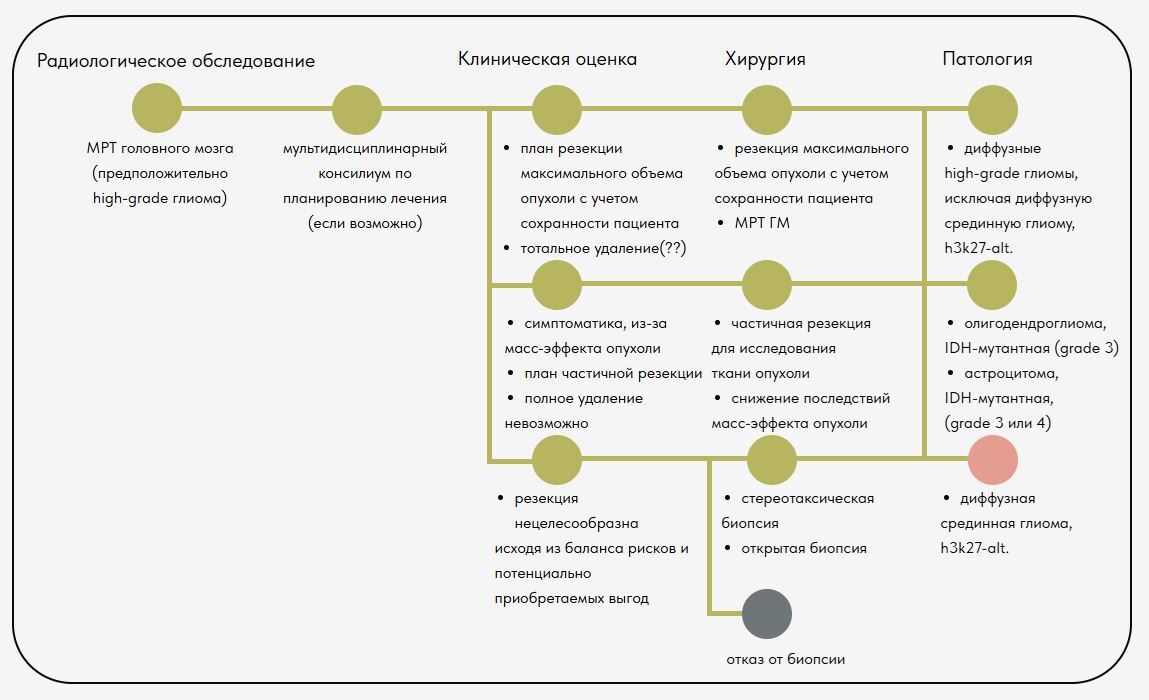
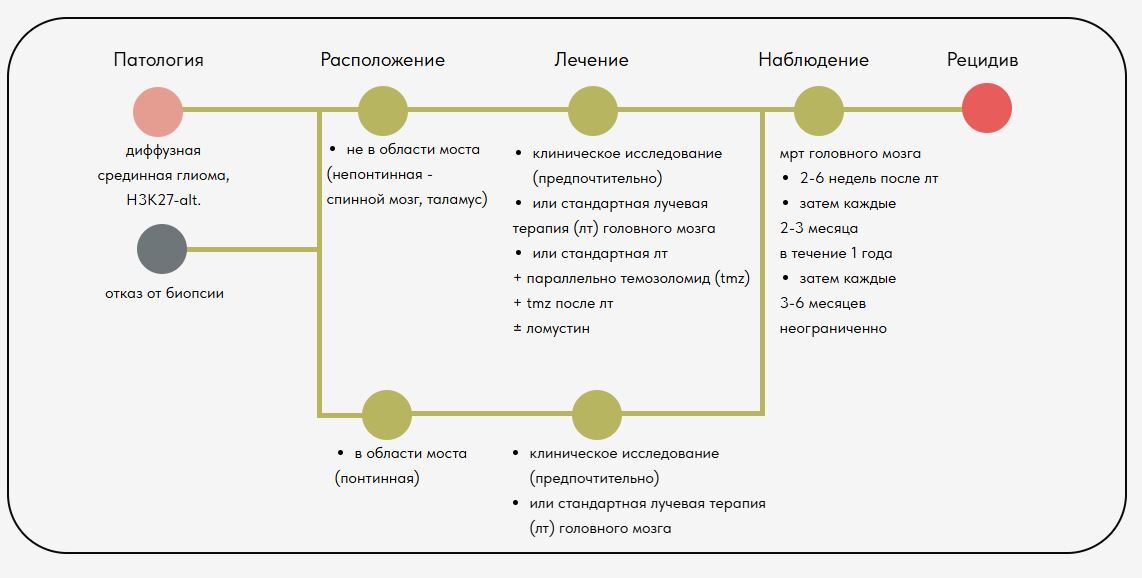
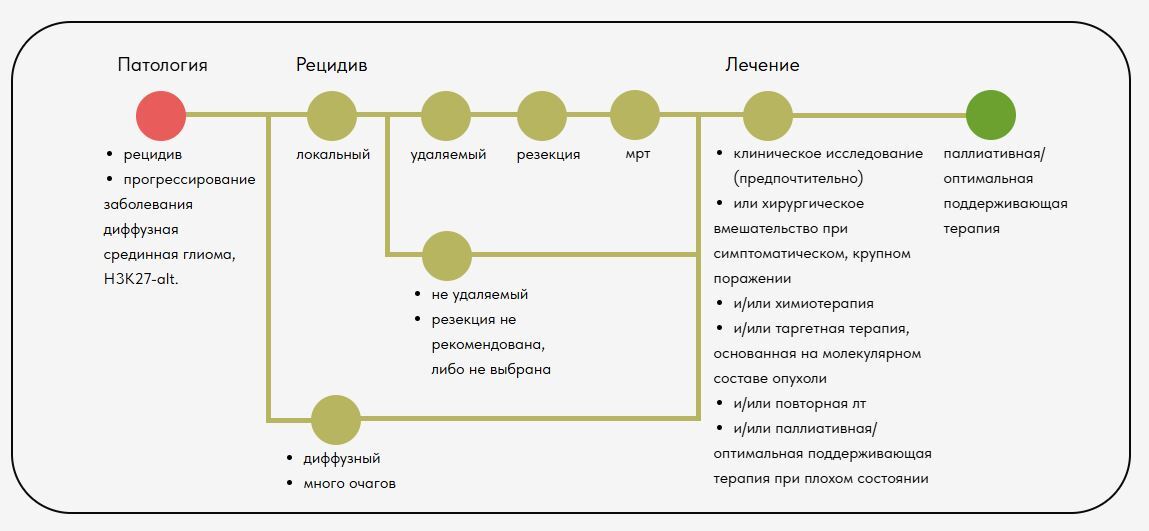
Ниже представлены типовые дорожные карты согласно
Руководству по клинической практике в онкологии
"Педиатрические онкологические заболевания центральной нервной системы"
Выпуск 2.2025 - 17 января 2025 года
Руководству по клинической практике в онкологии
"Педиатрические онкологические заболевания центральной нервной системы"
Выпуск 2.2025 - 17 января 2025 года
ДОРОЖНЫЕ КАРТЫ
00
СИМПТОМАТИЧЕСКАЯ ТЕРАПИЯ
ВИДЫ ЛЕЧЕНИЯ
Применение стероидов у пациентов с DIPG
Стероиды играют важную роль в терапии пациентов с диффузной внутренней глиомой моста (DIPG), особенно в момент ее выявления. Кортикостероиды используются для уменьшения отека головного мозга при различных заболеваниях, в особенности при агрессивных опухолях мозга. Дексаметазон обычно считается наиболее предпочтительным стероидом из-за его превосходной способности проникать в мозг и более длительного периода полувыведения (время, необходимое для того, чтобы лекарство потеряло половину своей фармакологической активности). Роль стероидов в терапии заболевания на этапе прогрессирования заболевания и во время паллиативного ухода остается противоречивой. Цель данного раздела - рассмотреть роль стероидов в лечении пациентов с диффузной внутренней глиомой моста.
Стероиды на ранних этапах терапии DIPG.
В момент постановки диагноза стероиды обычно являются первичным методом терапии пациентов с диффузной внутренней глиомой моста. Хотя их роль никогда не была должным образом оценена, большинство врачей назначают стероиды, и в частности дексаметазон, после постановки диагноза DIPG. Используемые дозы могут варьироваться индивидуально в зависимости от клинических проявлений и симптомов ребенка, но многие врачи используют большие дозы, до 10 мг на 1м2 поверхности тела в день (в два или три приема). Цель терапии - а) улучшить неврологические аспекты, б) уменьшить отек вокруг опухоли, который иногда может повлиять на отток спинномозговой жидкости (СМЖ) и вызвать определенную степень гидроцефалии, и в) предотвратить или минимизировать отек, вызванный началом лучевой терапии. Традиционно врачи сохраняют дозировку дексаметазона неизменной в течение первой недели терапии, а затем постепенно снижают ее по мере улучшения неврологических показателей в ходе лучевой терапии. Некоторые врачи предпочитают поддерживать высокую дозу стероидов на протяжении всех 6 недель лучевой терапии.
Однако стероиды связаны со значительными побочными эффектами, которые могут повлиять на качество жизни пациентов с диффузной внутренней глиомой моста. Одним из наиболее значимых побочных эффектов является гиперфагия - чувство крайнего сильного голода. В результате дети с DIPG часто значительно прибавляют в весе в первые недели терапии. Применение стероидов также связано с изменениями психики, такими как перепады настроения, тревожность или повышенная агрессивность (см. ниже). Нередки кожные осложнения, особенно у подростков, у которых могут появиться угревая сыпь и растяжки (или стрии). Все эти побочные эффекты проходят в течение нескольких недель после уменьшения или прекращения приема стероидов. Они сохранятся, если продолжать прием стероидов на протяжении всего курса лечения.
Стероиды после лучевой терапии.
До 50 процентов пациентов с DIPG будут демонстрировать симптомы так называемой «сонливости» в течение нескольких недель после завершения лучевой терапии. Начало этих симптомов обычно наблюдается через 2-4 недели после последнего сеанса лучевой терапии, но может наступить и раньше, и позже.
Синдром "сонливости" включает в себя симптомы от легкой сонливости до выраженной вялости с длительными периодами сна, раздражительности, анорексии, пониженной температуры, тошноты и рвоты, мозжечковой атаксии, дизартрии, дисфагии и головных болей. Для многих родителей, которые не были информированы об этом осложнении, синдром "сонливости" наводит на мысль о начальных проявлениях заболевания. Физиопатологические механизмы этого явления до конца не изучены, но считается, что "сонливость" связана с радиационно-индуцированным нарушением миелинизации. Период «сонливости» обычно длится 2 недели, и симптомы обычно исчезают внезапно. Однако у некоторых пациентов симптомы могут сохраняться до 4-6 недель. Когда симптомы очень выражены, применение стероидов может быть целесообразно. Оптимальная доза стероидов, необходимая в данном случае, неизвестна. Однако заметное улучшение аппетита и сонливости наблюдается при использовании небольших доз дексаметазона в диапазоне от 0,5 до 1 мг в день.
Стероиды в период прогрессирования заболевания.
Благодаря своему благотворному действию в момент постановки первичного диагноза, стероиды часто используются при рецидиве заболевания и во время паллиативного ухода за пациентами с DIPG. Они нередко вызывают заметное улучшение рецидивирующей неврологической симптоматики и обычно назначаются с краткосрочной целью облегчения симптомов прогрессирования. Однако их эффективность, как правило, оказывается временной, и симптомы прогрессирования заболевания возобновляются в течение одной-двух недель после назначения кортикостероидов. На этом этапе возникает дилемма: увеличивать ли дозу препарата для облегчения симптомов или прекратить прием стероидов из-за их потенциальных побочных эффектов. Врачам и семьям нелегко сделать этот выбор, и решение должно приниматься с четким пониманием последствий длительного применения стероидов во время паллиативного ухода.
Хотя стероиды могут обеспечить временное улучшение неврологической картины, у них есть побочные эффекты, вызывающие особую озабоченность в условиях прогрессирующей DIPG. Повышенный аппетит и обусловленная им гиперфагия могут привести к резкому увеличению веса и трансформации тела, в частности к формированию кушингоидной внешности с классическим лунообразным лицом. Эти изменения могут иметь значительные эстетические и социально-психологические последствия, приводящие к стеснению и изоляции. Они также могут отразиться на родителях, братьях, сестрах и родственниках в момент тяжелой утраты, когда они вспоминают косметические последствия применения стероидов. Кроме того, при рассмотрении вопроса о применении стероидов необходимо учитывать конкретные аспекты паллиативного лечения и прогрессирования симптомов у пациентов с DIPG. Поражение нижних отделов черепных нервов приводит к нарушениям глотания и риску подавиться. В этом случае стероиды могут оказать нежелательное воздействие, поскольку они повышают аппетит и, следовательно, риск поперхнуться у постоянно голодного пациента. По мере ухудшения глотательных функций влияние стероидов на аппетит может стать проблемой и превратиться в навязчивое состояние для ребенка, который не может ни есть, ни пить. Кроме того, сочетание оро-фарингеального застоя выделений и подавления системы иммунитета часто приводит к развитию болезненной молочницы, которая требует специального лечения с помощью полоскания рта и, в некоторых случаях, антимикробных препаратов против кандидоза.
Другие побочные эффекты стероидов могут оказывать значительное влияние на качество паллиативной помощи. В частности, это касается поведенческих побочных эффектов, которые могут повлиять на качество взаимоотношений пациента с его семьей.
В целом, решение об использовании стероидов в период прогрессирования заболевания должно приниматься с четким пониманием потенциальных последствий такого выбора. К ним относится риск попасть в замкнутый круг, поскольку прогрессирующее обострение заболевания приводит к увеличению дозы стероидов и, как следствие, к усилению побочных эффектов. Ведение пациентов с DIPG без стероидов возможно, и некоторые команды нейроонкологов предпочитают избегать их применения в период прогрессирования заболевания.
Оригинал статьи здесь.
Стероиды на ранних этапах терапии DIPG.
В момент постановки диагноза стероиды обычно являются первичным методом терапии пациентов с диффузной внутренней глиомой моста. Хотя их роль никогда не была должным образом оценена, большинство врачей назначают стероиды, и в частности дексаметазон, после постановки диагноза DIPG. Используемые дозы могут варьироваться индивидуально в зависимости от клинических проявлений и симптомов ребенка, но многие врачи используют большие дозы, до 10 мг на 1м2 поверхности тела в день (в два или три приема). Цель терапии - а) улучшить неврологические аспекты, б) уменьшить отек вокруг опухоли, который иногда может повлиять на отток спинномозговой жидкости (СМЖ) и вызвать определенную степень гидроцефалии, и в) предотвратить или минимизировать отек, вызванный началом лучевой терапии. Традиционно врачи сохраняют дозировку дексаметазона неизменной в течение первой недели терапии, а затем постепенно снижают ее по мере улучшения неврологических показателей в ходе лучевой терапии. Некоторые врачи предпочитают поддерживать высокую дозу стероидов на протяжении всех 6 недель лучевой терапии.
Однако стероиды связаны со значительными побочными эффектами, которые могут повлиять на качество жизни пациентов с диффузной внутренней глиомой моста. Одним из наиболее значимых побочных эффектов является гиперфагия - чувство крайнего сильного голода. В результате дети с DIPG часто значительно прибавляют в весе в первые недели терапии. Применение стероидов также связано с изменениями психики, такими как перепады настроения, тревожность или повышенная агрессивность (см. ниже). Нередки кожные осложнения, особенно у подростков, у которых могут появиться угревая сыпь и растяжки (или стрии). Все эти побочные эффекты проходят в течение нескольких недель после уменьшения или прекращения приема стероидов. Они сохранятся, если продолжать прием стероидов на протяжении всего курса лечения.
Стероиды после лучевой терапии.
До 50 процентов пациентов с DIPG будут демонстрировать симптомы так называемой «сонливости» в течение нескольких недель после завершения лучевой терапии. Начало этих симптомов обычно наблюдается через 2-4 недели после последнего сеанса лучевой терапии, но может наступить и раньше, и позже.
Синдром "сонливости" включает в себя симптомы от легкой сонливости до выраженной вялости с длительными периодами сна, раздражительности, анорексии, пониженной температуры, тошноты и рвоты, мозжечковой атаксии, дизартрии, дисфагии и головных болей. Для многих родителей, которые не были информированы об этом осложнении, синдром "сонливости" наводит на мысль о начальных проявлениях заболевания. Физиопатологические механизмы этого явления до конца не изучены, но считается, что "сонливость" связана с радиационно-индуцированным нарушением миелинизации. Период «сонливости» обычно длится 2 недели, и симптомы обычно исчезают внезапно. Однако у некоторых пациентов симптомы могут сохраняться до 4-6 недель. Когда симптомы очень выражены, применение стероидов может быть целесообразно. Оптимальная доза стероидов, необходимая в данном случае, неизвестна. Однако заметное улучшение аппетита и сонливости наблюдается при использовании небольших доз дексаметазона в диапазоне от 0,5 до 1 мг в день.
Стероиды в период прогрессирования заболевания.
Благодаря своему благотворному действию в момент постановки первичного диагноза, стероиды часто используются при рецидиве заболевания и во время паллиативного ухода за пациентами с DIPG. Они нередко вызывают заметное улучшение рецидивирующей неврологической симптоматики и обычно назначаются с краткосрочной целью облегчения симптомов прогрессирования. Однако их эффективность, как правило, оказывается временной, и симптомы прогрессирования заболевания возобновляются в течение одной-двух недель после назначения кортикостероидов. На этом этапе возникает дилемма: увеличивать ли дозу препарата для облегчения симптомов или прекратить прием стероидов из-за их потенциальных побочных эффектов. Врачам и семьям нелегко сделать этот выбор, и решение должно приниматься с четким пониманием последствий длительного применения стероидов во время паллиативного ухода.
Хотя стероиды могут обеспечить временное улучшение неврологической картины, у них есть побочные эффекты, вызывающие особую озабоченность в условиях прогрессирующей DIPG. Повышенный аппетит и обусловленная им гиперфагия могут привести к резкому увеличению веса и трансформации тела, в частности к формированию кушингоидной внешности с классическим лунообразным лицом. Эти изменения могут иметь значительные эстетические и социально-психологические последствия, приводящие к стеснению и изоляции. Они также могут отразиться на родителях, братьях, сестрах и родственниках в момент тяжелой утраты, когда они вспоминают косметические последствия применения стероидов. Кроме того, при рассмотрении вопроса о применении стероидов необходимо учитывать конкретные аспекты паллиативного лечения и прогрессирования симптомов у пациентов с DIPG. Поражение нижних отделов черепных нервов приводит к нарушениям глотания и риску подавиться. В этом случае стероиды могут оказать нежелательное воздействие, поскольку они повышают аппетит и, следовательно, риск поперхнуться у постоянно голодного пациента. По мере ухудшения глотательных функций влияние стероидов на аппетит может стать проблемой и превратиться в навязчивое состояние для ребенка, который не может ни есть, ни пить. Кроме того, сочетание оро-фарингеального застоя выделений и подавления системы иммунитета часто приводит к развитию болезненной молочницы, которая требует специального лечения с помощью полоскания рта и, в некоторых случаях, антимикробных препаратов против кандидоза.
Другие побочные эффекты стероидов могут оказывать значительное влияние на качество паллиативной помощи. В частности, это касается поведенческих побочных эффектов, которые могут повлиять на качество взаимоотношений пациента с его семьей.
В целом, решение об использовании стероидов в период прогрессирования заболевания должно приниматься с четким пониманием потенциальных последствий такого выбора. К ним относится риск попасть в замкнутый круг, поскольку прогрессирующее обострение заболевания приводит к увеличению дозы стероидов и, как следствие, к усилению побочных эффектов. Ведение пациентов с DIPG без стероидов возможно, и некоторые команды нейроонкологов предпочитают избегать их применения в период прогрессирования заболевания.
Оригинал статьи здесь.
Побочные эффекты кортикостероидов.
Побочные эффекты кортикостероидов.
Стероиды связаны с рядом потенциально серьезных побочных эффектов. Проявление и тяжесть этих побочных эффектов обычно коррелируют с дозой и продолжительностью лечения. При непродолжительном приеме (2-3 недели) большинство побочных эффектов проходит после прекращения использования кортикостероидов. Однако некоторым детям может потребоваться длительное применение стероидов из-за сохраняющихся или рецидивирующих симптомов, или некоторые врачи не хотят снижать дозу стероидов во время проведения лучевой терапии. В этом случае побочные эффекты могут сохраняться или даже усугубляться с течением времени и значительно ухудшать качество жизни ребенка. Использование минимально возможной дозы стероидов снизит риск этих осложнений.
К косметическим побочным эффектам относятся кушингоидная внешность, туловищное ожирение, гирсутизм (избыточное оволосение), угревая сыпь и растяжки. Среди других побочных эффектов - повышение аппетита, снижение иммунитета, гипертония, непереносимость глюкозы, электролитные нарушения, задержка жидкости, периферические отеки, побочные эффекты со стороны желудочно-кишечного тракта, остеопороз, аваскулярный некроз, задержка роста и проблемы со зрением. Среди распространенных побочных эффектов стероидов особое беспокойство вызывают увеличение веса, стероидная миопатия, пневмоцистная пневмония и изменения в поведении пациентов с DIPG.
Гиперфагия.
Применение высоких доз дексаметазона во время начала лучевой терапии связано с моментальным повышением аппетита. В результате дети могут резко прибавить в весе в течение нескольких дней, и попытки контролировать их аппетит часто оказываются затруднительными из-за связанных с этим перепадов настроения и изменений в поведении. Использование напитков, не содержащих калорий, может помочь ограничить набор веса. Когда пациенту удается отменить стероиды, прибавка в весе носит временный характер, и большинство детей возвращаются к исходному весу в течение нескольких недель. Однако при продолжении приема стероидов гиперфагия может привести к значительному увеличению веса, что еще больше ограничит подвижность пациента, и без того страдающего неврологическими нарушениями.
Нарушения психики
Нейропсихатрические эффекты применения стероидов, вероятно, наиболее распространены и вызывают наибольший стресс у родителей и ухаживающих за детьми лиц, которые часто говорят, что «их ребенок не такой, как прежде». Стероиды могут вызывать тревогу, бессонницу и раздражительность. Иногда в клинической практике бывает трудно отличить эти проявления от признаков глиомы, облучения головного мозга или изменения внутричерепного давления, и нередко врачи требуют проведения КТ или МРТ, чтобы исключить такие осложнения, как внутримозговые кровоизлияния. Однако стероиды, принимаемые в очень высоких дозах, несомненно, оказывают значительное влияние на поведение некоторых детей и негативно сказываются на качестве их жизни. Лечение этих нейропсихиатрических побочных эффектов заключается в прекращении или уменьшении дозы стероидов как можно скорее. Использование нейролептиков может быть рассмотрено в индивидуальном порядке, когда отмена стероидов представляется невозможной.
Миопатия.
Стероидная миопатия - осложнение, которое может существенно повлиять на качество жизни пациентов с DIPG. Клиническим проявлением стероидной миопатии является прогрессирующая слабость, затрагивающая преимущественно нижние конечности, которая может влиять на способность ходить. Некоторым детям в результате стероидной миопатии может потребоваться инвалидная коляска. К другим последствиям относятся трудности с подъемом и спуском по лестнице и неспособность к бегу. Боли в спине не являются чем-то необычным и, по-видимому, являются следствием как миопатии, так и остеопороза. Стероидная миопатия обычно облегчается после прекращения приема препарата или снижения дозы. Однако восстановление может занять несколько месяцев после отмены стероидов. Стероидная миопатия развивается не у всех пациентов, и точный механизм этого осложнения неизвестен. У некоторых пациентов тяжелые симптомы миопатии проявляются через 2-3 недели приема стероидов, в то время как у других пациентов, получающих лечение в течение нескольких месяцев, симптомы могут быть минимальными или вообще отсутствовать. По-видимому, регулярные физические упражнения или физиотерапевтические программы могут помочь уменьшить выраженность миопатии.
Желудочно-кишечные кровотечения и язвы.
Пациенты, принимающие кортикостероиды, также обычно получают препараты, снижающие риск развития язвы желудка и кровотечения. Хотя у детей с опухолями мозга, получающих стероиды, не было выявлено значительной связи между применением стероидов и желудочно-кишечными кровотечениями или язвами, разумно использовать H2-антагонисты (в России чаще используют ингибиторы протонной помпы - ИПП, такие как Омепразол или Нексиум) у пациентов с DIPG, получающих кортикостероиды в течение длительного времени, особенно если пациенты получают очень высокие дозы кортикостероидов. Однако у большинства пациентов, получающих 1 или 2 мг дексаметазона в день, систематическое применение H2-антагонистов (либо ИПП) представляется необоснованным, а прием кортикостероидов дважды в день во время еды снижает риск раздражения желудка и избавляет от побочных эффектов и расходов на H2-антагонисты (ИПП).
Влияние кортикостероидов на иммунную систему.
Дексаметазон и другие кортикостероиды могут вызывать снижение иммунитета, подавляя иммунные и воспалительные реакции и уменьшая количество лимфоцитов. Поэтому применение глюкокортикоидов повышает риск развития условно-патогенных инфекций. В частности, Pneumocystis carinii (PCP) - это грибковая инфекция, вызывающая опасные для жизни легочные инфекции у пациентов с ослабленным иммунитетом. Появляется все больше доказательств того, что у пациентов с опухолями головного мозга, получающих высокие дозы стероидов, повышен риск PCP, а в нескольких исследованиях DIPG были зарегистрированы случаи PCP в результате только применения стероидов (без сопутствующей химиотерапии). Поэтому рекомендуется рассмотреть вопрос о профилактике PCP при длительном применении стероидов, в частности, когда пациенты не могут отказаться от стероидов.
В условиях прогрессирующего заболевания нарушения глотания могут привести к значительному оро-фарингеальному застою мокроты. Иммуносупрессивный эффект стероидов повышает риск развития ротовой молочницы (грибковой инфекции), которая может быть чрезвычайно болезненной и трудно поддающейся лечению.
Оригинал статьи здесь.
Стероиды связаны с рядом потенциально серьезных побочных эффектов. Проявление и тяжесть этих побочных эффектов обычно коррелируют с дозой и продолжительностью лечения. При непродолжительном приеме (2-3 недели) большинство побочных эффектов проходит после прекращения использования кортикостероидов. Однако некоторым детям может потребоваться длительное применение стероидов из-за сохраняющихся или рецидивирующих симптомов, или некоторые врачи не хотят снижать дозу стероидов во время проведения лучевой терапии. В этом случае побочные эффекты могут сохраняться или даже усугубляться с течением времени и значительно ухудшать качество жизни ребенка. Использование минимально возможной дозы стероидов снизит риск этих осложнений.
К косметическим побочным эффектам относятся кушингоидная внешность, туловищное ожирение, гирсутизм (избыточное оволосение), угревая сыпь и растяжки. Среди других побочных эффектов - повышение аппетита, снижение иммунитета, гипертония, непереносимость глюкозы, электролитные нарушения, задержка жидкости, периферические отеки, побочные эффекты со стороны желудочно-кишечного тракта, остеопороз, аваскулярный некроз, задержка роста и проблемы со зрением. Среди распространенных побочных эффектов стероидов особое беспокойство вызывают увеличение веса, стероидная миопатия, пневмоцистная пневмония и изменения в поведении пациентов с DIPG.
Гиперфагия.
Применение высоких доз дексаметазона во время начала лучевой терапии связано с моментальным повышением аппетита. В результате дети могут резко прибавить в весе в течение нескольких дней, и попытки контролировать их аппетит часто оказываются затруднительными из-за связанных с этим перепадов настроения и изменений в поведении. Использование напитков, не содержащих калорий, может помочь ограничить набор веса. Когда пациенту удается отменить стероиды, прибавка в весе носит временный характер, и большинство детей возвращаются к исходному весу в течение нескольких недель. Однако при продолжении приема стероидов гиперфагия может привести к значительному увеличению веса, что еще больше ограничит подвижность пациента, и без того страдающего неврологическими нарушениями.
Нарушения психики
Нейропсихатрические эффекты применения стероидов, вероятно, наиболее распространены и вызывают наибольший стресс у родителей и ухаживающих за детьми лиц, которые часто говорят, что «их ребенок не такой, как прежде». Стероиды могут вызывать тревогу, бессонницу и раздражительность. Иногда в клинической практике бывает трудно отличить эти проявления от признаков глиомы, облучения головного мозга или изменения внутричерепного давления, и нередко врачи требуют проведения КТ или МРТ, чтобы исключить такие осложнения, как внутримозговые кровоизлияния. Однако стероиды, принимаемые в очень высоких дозах, несомненно, оказывают значительное влияние на поведение некоторых детей и негативно сказываются на качестве их жизни. Лечение этих нейропсихиатрических побочных эффектов заключается в прекращении или уменьшении дозы стероидов как можно скорее. Использование нейролептиков может быть рассмотрено в индивидуальном порядке, когда отмена стероидов представляется невозможной.
Миопатия.
Стероидная миопатия - осложнение, которое может существенно повлиять на качество жизни пациентов с DIPG. Клиническим проявлением стероидной миопатии является прогрессирующая слабость, затрагивающая преимущественно нижние конечности, которая может влиять на способность ходить. Некоторым детям в результате стероидной миопатии может потребоваться инвалидная коляска. К другим последствиям относятся трудности с подъемом и спуском по лестнице и неспособность к бегу. Боли в спине не являются чем-то необычным и, по-видимому, являются следствием как миопатии, так и остеопороза. Стероидная миопатия обычно облегчается после прекращения приема препарата или снижения дозы. Однако восстановление может занять несколько месяцев после отмены стероидов. Стероидная миопатия развивается не у всех пациентов, и точный механизм этого осложнения неизвестен. У некоторых пациентов тяжелые симптомы миопатии проявляются через 2-3 недели приема стероидов, в то время как у других пациентов, получающих лечение в течение нескольких месяцев, симптомы могут быть минимальными или вообще отсутствовать. По-видимому, регулярные физические упражнения или физиотерапевтические программы могут помочь уменьшить выраженность миопатии.
Желудочно-кишечные кровотечения и язвы.
Пациенты, принимающие кортикостероиды, также обычно получают препараты, снижающие риск развития язвы желудка и кровотечения. Хотя у детей с опухолями мозга, получающих стероиды, не было выявлено значительной связи между применением стероидов и желудочно-кишечными кровотечениями или язвами, разумно использовать H2-антагонисты (в России чаще используют ингибиторы протонной помпы - ИПП, такие как Омепразол или Нексиум) у пациентов с DIPG, получающих кортикостероиды в течение длительного времени, особенно если пациенты получают очень высокие дозы кортикостероидов. Однако у большинства пациентов, получающих 1 или 2 мг дексаметазона в день, систематическое применение H2-антагонистов (либо ИПП) представляется необоснованным, а прием кортикостероидов дважды в день во время еды снижает риск раздражения желудка и избавляет от побочных эффектов и расходов на H2-антагонисты (ИПП).
Влияние кортикостероидов на иммунную систему.
Дексаметазон и другие кортикостероиды могут вызывать снижение иммунитета, подавляя иммунные и воспалительные реакции и уменьшая количество лимфоцитов. Поэтому применение глюкокортикоидов повышает риск развития условно-патогенных инфекций. В частности, Pneumocystis carinii (PCP) - это грибковая инфекция, вызывающая опасные для жизни легочные инфекции у пациентов с ослабленным иммунитетом. Появляется все больше доказательств того, что у пациентов с опухолями головного мозга, получающих высокие дозы стероидов, повышен риск PCP, а в нескольких исследованиях DIPG были зарегистрированы случаи PCP в результате только применения стероидов (без сопутствующей химиотерапии). Поэтому рекомендуется рассмотреть вопрос о профилактике PCP при длительном применении стероидов, в частности, когда пациенты не могут отказаться от стероидов.
В условиях прогрессирующего заболевания нарушения глотания могут привести к значительному оро-фарингеальному застою мокроты. Иммуносупрессивный эффект стероидов повышает риск развития ротовой молочницы (грибковой инфекции), которая может быть чрезвычайно болезненной и трудно поддающейся лечению.
Оригинал статьи здесь.
Альтернативы кортикостероидам.
Большое количество осложнений, связанных с длительным или многократным применением кортикостероидов, привело к поиску альтернативных методов терапии перитуморального отека при опухолях головного мозга, и в частности при DIPG.
Xerecept® (в России не зарегистрирован) - синтетический аналог естественного человеческого пептида кортикотропин-рилизинг-фактора (КРФ). В нескольких исследованиях на животных была показана способность КРФ уменьшать отек мозга, вызванный опухолями мозга. Кортикотропин-рилизинг фактор, по-видимому, уменьшает перитуморальный отек за счет прямого воздействия на кровеносные сосуды, не зависящего от выброса стероидов надпочечниками. Клинические испытания показали многообещающую активность против перитуморального отека при опухолях мозга у взрослых. Рандомизированное исследование показало, что Ксерецепт® помогает пациентам с симптомами перитуморального отека, связанного с первичными или метастатическими опухолями головного мозга, позволяя им сократить/прекратить лечение дексаметазоном, тем самым снижая вероятность возникновения связанных со стероидами побочных эффектов - миопатии, кушингоидных симптомов и кожных заболеваний.
Ингибиторы циклооксигеназы-2 (например, Celebrex) использовались некоторыми врачами в терапии прогрессирующей DIPG, как самостоятельно, так и в комбинации со стероидами. Было высказано предположение, что они могут быть эффективны для лечения отека головного мозга. Однако кардиологические осложнения этого класса препаратов значительно сократили их применение у детей.
Поскольку фактор роста эндотелия сосудов Vascular Endothelial Growth Factor, (VEGF) играет важную роль в развитии перитуморального отека, использование ингибиторов VEGF, таких как VEGF-антитела (например, бевацизумаб/препарат Авастин®), представляется логичным вариантом в поиске альтернативы кортикостероидам. В контексте DIPG было проведено небольшое исследование, в котором описывалась эффективность бевацизумаба у детей с DIPG с подозрением на лучевой некроз. Четверо детей с симптомами получали бевацизумаб в течение периода от 3 недель до 3 месяцев после завершения лучевой терапии в дозе 10 мг/кг каждые две недели в общей сложности от 3 до 6 инфузий. Терапия переносилась хорошо, без побочных эффектов. Трое из 4 детей смогли отказаться от стероидов и имели значительное клиническое улучшение неврологических симптомов. Планируются дальнейшие исследования, чтобы лучше определить роль этого препарата в лечении детей с DIPG.
Подводя итоги.
Стероиды и, в частности, дексаметазон играют важную роль в терапии пациентов с DIPG. Однако из-за отсутствия долгосрочных исследований по применению стероидов при этом заболевании наши знания об оптимальной дозировке и графике приема, включая отмену, остаются ограниченными, и большинство врачей полагаются на свой собственный опыт при назначении стероидов в этом контексте. В настоящее время в клинической практике наблюдается значительное расхождение, и мы надеемся, что будущие исследования позволят получить более полное представление об оптимальном применении стероидов при DIPG, а также о потенциальных альтернативах стероидам.
Оригинал статьи здесь.
Практические советы от родителей (на английском) здесь
01
ХИРУРГИЯ
Варианты хирургического лечения диффузных внутренних глиом моста (DIPG)
Проблема оперирования диффузных внутренних глиом моста (diffuse intrinsic pontine glioma - DIPG) сразу же вытекает из самого названия - они диффузные, внутренние и находятся в области моста головного мозга. Опухоли в других частях мозга обычно растут в виде объема, который отодвигает более нормальную ткань мозга, но DIPG этого не делают. Опухоли из клеток DIPG обычно не являются большими отдельными образованиями, которые хирург может попытаться удалить (но бывает, что DIPG имеет диффузный и солидный компонент, и тогда частичное удаление возможно - здесь и далее прим. авт.). Вместо этого клетки, составляющие опухоль, диффузно выступают в виде пальцев (еще есть аналогия со жвачкой в волосах), которые располагаются широко среди других участков нормальной ткани мозга.
При опухолях DIPG невозможно отделить нормальную ткань от аномальной, когда хирург смотрит на нее. Таким образом, попытка удалить большие куски ткани, чтобы попытаться значительно уменьшить объем опухоли (и улучшить исход заболевания ребенка за счет удаления достаточного количества опухоли), невозможна. Вместо этого попытки удалить аномальную ткань приводят к удалению кусочков нормальной ткани мозга. Удаление нормальной ткани может происходить и при операциях на других частях мозга, но в других частях мозга близлежащие нормальные ткани обычно не выполняют таких важных функций, как ткани моста.
Область моста (pons).
Область моста (pons) - это небольшая область мозга длиной около 3,5 см и шириной 2,5 см. В нем находятся мозговые центры, контролирующие сон и бодрствование, движения глаз, мимику и слух. Через него сложным образом проходят основные пути движения рук и ног, а также большинство ощущений тела. Мозжечок, расположенный за мостом, посылает сигналы от одной стороны мозга к другой через мост. Мозжечок контролирует плавность мышечных движений и равновесие, также некоторые центры равновесия расположены в области моста мозга. Дополнительные центры, контролирующие равновесие, расположены в продолговатом мозге. Таким образом, область моста мозга - это важнейшая структура, которая оказывает большое влияние на способность всего организма функционировать должным образом. Повреждение в области моста может оказать чрезвычайно сильное влияние на способность организма к самоподдержанию. Любой хирург должен быть крайне осторожен при попытке проведения операции в этой области. Забор небольшого количества ткани может быть возможен без серьезных неврологических повреждений, но забор большого количества ткани (обычно) просто невозможен.
История диагностики и визуализации DIPG
Современные представления хирургов об опухолях DIPG основаны на истории развития опухолей. В прошлом хирурги обычно старались удалять опухоли мозга. Но это было и остается редко возможным при опухолях головного мозга. При опухолях в других областях тела хирурги обычно пытаются взять небольшое количество ткани с помощью «игольчатой биопсии», чтобы получить более полное представление об опухоли, прежде чем рассматривать возможность проведения более масштабной операции. Однако биопсия редко проводилась при опухолях мозга, потому что в мозге биопсия была намного сложнее, чем в других частях тела. Причина трудностей заключалась в том, что раньше было очень сложно точно определить, в каком месте черепа, а значит, и мозга, должна проходить игла, чтобы поставить диагноз. Хотя хирурги использовали различные внешние ориентиры для введения игл в мозг, эта техника, называемая стереотаксической биопсией, была недостаточно хороша для широкого применения. Сорок лет назад ситуация начала меняться. Новая технология компьютерной визуализации мозга неожиданно позволила увидеть анатомические детали удивительным образом. Техника стереотаксической биопсии стала осуществимой на практике, и хирурги начали ее использовать.
Тем временем сама визуализация мозга стала гораздо более точной. В частности, МРТ произвела революцию в способности хирургов понимать и визуализировать расположение опухолей, особенно в задней черепной ямке - задней части мозга, где расположена область моста. МРТ и стереотаксические технологии теперь были связаны конструктивно, и хирурги начали пробовать стереотаксическую биопсию в области моста.
Биопсия более распространенных опухолей: Почему или почему нет?
Фундаментальная этическая дилемма, возникающая в связи с существующим стандартом лечения, заключается в том, что если опухоль выглядит типично на МРТ, то, согласно рекомендациям (основанным на исследованиях, проведенных 20 лет назад), биопсию делать не следует. Потенциальный риск для конкретного ребенка, как он трактовался в то время, не мог быть сбалансирован потенциальной пользой. С тех пор изменились две вещи:
Решение о том, в каких случаях оперировать
Решение о том, оперировать или нет, должно основываться на визуализации опухоли и на том, подходит ли лечение конкретному ребенку.
Проблему (помимо самой опухоли) представляет местоположение DIPG. Мозг вырабатывает спинномозговую жидкость (СМЖ), которая циркулирует по ряду пространств в мозге, называемых желудочками, к которым относятся:
Клинические рекомендации стандартного протокола лечения
Детские онкологи давно сотрудничают друг с другом, пытаясь разработать новые лучшие методы лечения опухолей наиболее эффективным способом. В одном из таких совместных исследований, организованном Детской онкологической группой (исследование CCG 9928), изучались пациенты с диффузными внутренними глиомами моста и предлагались новые методы лечения. Это исследование, опубликованное в 1993 году, пришло к выводу, что если на МРТ видны характерные признаки изменений в области моста, это является достаточным основанием для постановки диагноза диффузной внутренней глиомы моста без биопсии. Также выяснилось, что при взятии биопсии результат патологии не помогает спланировать определенную стратегию лечения и не влияет на последующий исход заболевания. Поэтому была дана рекомендация не проводить биопсию в случаях, когда речь идет о типичных внутренних глиомах моста.
В то время риск вреда от биопсии еще не был хорошо известен, поскольку технология стереотаксической биопсии была еще относительно новой. Но поскольку польза от биопсии так мала, риски были слишком велики, чтобы ее проводить. На основании этих исторических данных был принят стандарт лечения, согласно которому биопсию при опухолях DIPG делать не нужно.
Когда нейрохирург, онколог и радиолог сходятся во мнении, что опухоль не похожа на типичную DIPG, считается целесообразным провести биопсию. После публикации исследования CCG 9928 во многих других публикациях была подтверждена безопасность стереотаксической биопсии в задней черепной ямке с относительно небольшим количеством причиненного вреда. Таким образом, решение о проведении биопсии основывается на том, является ли опухоль настолько атипичной, что можно рассматривать другой диагноз. Кроме того, некоторые опухоли, по мнению хирурга, онколога и радиолога, остаются настолько необычными, что более целесообразной является открытая операция (удаление лоскута черепа и проникновение в ткани мозга инструментами, превышающими по размеру иглу).
Федеральные рекомендации по проведению клинических исследований
Федеральные рекомендации по проведению исследований, особенно на детях, предусматривают, что процедура, связанная с более чем минимальным риском, должна быть полезна для конкретного ребенка. Какова польза от проведения процедуры; позволит ли она лучше понять природу опухоли; принесет ли она пользу конкретному ребенку? Как мы должны оценивать пользу? Если ребенок и его семья решат, что помощь в расширении знаний - это очень значительная польза для него, достаточно ли это существенно, чтобы компенсировать мнение о том, что, поскольку «выживаемость ребенка не изменится», потенциальной пользы нет? Это главный вопрос, на который нет простых ответов.
Оригинал статьи здесь.
При опухолях DIPG невозможно отделить нормальную ткань от аномальной, когда хирург смотрит на нее. Таким образом, попытка удалить большие куски ткани, чтобы попытаться значительно уменьшить объем опухоли (и улучшить исход заболевания ребенка за счет удаления достаточного количества опухоли), невозможна. Вместо этого попытки удалить аномальную ткань приводят к удалению кусочков нормальной ткани мозга. Удаление нормальной ткани может происходить и при операциях на других частях мозга, но в других частях мозга близлежащие нормальные ткани обычно не выполняют таких важных функций, как ткани моста.
Область моста (pons).
Область моста (pons) - это небольшая область мозга длиной около 3,5 см и шириной 2,5 см. В нем находятся мозговые центры, контролирующие сон и бодрствование, движения глаз, мимику и слух. Через него сложным образом проходят основные пути движения рук и ног, а также большинство ощущений тела. Мозжечок, расположенный за мостом, посылает сигналы от одной стороны мозга к другой через мост. Мозжечок контролирует плавность мышечных движений и равновесие, также некоторые центры равновесия расположены в области моста мозга. Дополнительные центры, контролирующие равновесие, расположены в продолговатом мозге. Таким образом, область моста мозга - это важнейшая структура, которая оказывает большое влияние на способность всего организма функционировать должным образом. Повреждение в области моста может оказать чрезвычайно сильное влияние на способность организма к самоподдержанию. Любой хирург должен быть крайне осторожен при попытке проведения операции в этой области. Забор небольшого количества ткани может быть возможен без серьезных неврологических повреждений, но забор большого количества ткани (обычно) просто невозможен.
История диагностики и визуализации DIPG
Современные представления хирургов об опухолях DIPG основаны на истории развития опухолей. В прошлом хирурги обычно старались удалять опухоли мозга. Но это было и остается редко возможным при опухолях головного мозга. При опухолях в других областях тела хирурги обычно пытаются взять небольшое количество ткани с помощью «игольчатой биопсии», чтобы получить более полное представление об опухоли, прежде чем рассматривать возможность проведения более масштабной операции. Однако биопсия редко проводилась при опухолях мозга, потому что в мозге биопсия была намного сложнее, чем в других частях тела. Причина трудностей заключалась в том, что раньше было очень сложно точно определить, в каком месте черепа, а значит, и мозга, должна проходить игла, чтобы поставить диагноз. Хотя хирурги использовали различные внешние ориентиры для введения игл в мозг, эта техника, называемая стереотаксической биопсией, была недостаточно хороша для широкого применения. Сорок лет назад ситуация начала меняться. Новая технология компьютерной визуализации мозга неожиданно позволила увидеть анатомические детали удивительным образом. Техника стереотаксической биопсии стала осуществимой на практике, и хирурги начали ее использовать.
Тем временем сама визуализация мозга стала гораздо более точной. В частности, МРТ произвела революцию в способности хирургов понимать и визуализировать расположение опухолей, особенно в задней черепной ямке - задней части мозга, где расположена область моста. МРТ и стереотаксические технологии теперь были связаны конструктивно, и хирурги начали пробовать стереотаксическую биопсию в области моста.
Биопсия более распространенных опухолей: Почему или почему нет?
Фундаментальная этическая дилемма, возникающая в связи с существующим стандартом лечения, заключается в том, что если опухоль выглядит типично на МРТ, то, согласно рекомендациям (основанным на исследованиях, проведенных 20 лет назад), биопсию делать не следует. Потенциальный риск для конкретного ребенка, как он трактовался в то время, не мог быть сбалансирован потенциальной пользой. С тех пор изменились две вещи:
- Безопасная биопсия образований ствола мозга проводится гораздо большему числу пациентов, чем в то время, когда было сделано это заключение;
- Возможности изучения опухолей значительно расширились благодаря геномному анализу.
Решение о том, в каких случаях оперировать
Решение о том, оперировать или нет, должно основываться на визуализации опухоли и на том, подходит ли лечение конкретному ребенку.
Проблему (помимо самой опухоли) представляет местоположение DIPG. Мозг вырабатывает спинномозговую жидкость (СМЖ), которая циркулирует по ряду пространств в мозге, называемых желудочками, к которым относятся:
- Боковые желудочки: В каждом полушарии головного мозга находится по одному боковому желудочку, и каждый боковой желудочек через небольшой канал (так называемый отверстие Монро) сообщается с третьим желудочком.
- Третий желудочек: Третий желудочек расположен по средней линии у основания мозга и заканчивается каналом, называемым акведуком Сильвиуса, который переходит в четвертый желудочек.
- Четвертый желудочек: Четвертый желудочек располагается за мостом и продолговатым мозгом, перед мозжечком.
Клинические рекомендации стандартного протокола лечения
Детские онкологи давно сотрудничают друг с другом, пытаясь разработать новые лучшие методы лечения опухолей наиболее эффективным способом. В одном из таких совместных исследований, организованном Детской онкологической группой (исследование CCG 9928), изучались пациенты с диффузными внутренними глиомами моста и предлагались новые методы лечения. Это исследование, опубликованное в 1993 году, пришло к выводу, что если на МРТ видны характерные признаки изменений в области моста, это является достаточным основанием для постановки диагноза диффузной внутренней глиомы моста без биопсии. Также выяснилось, что при взятии биопсии результат патологии не помогает спланировать определенную стратегию лечения и не влияет на последующий исход заболевания. Поэтому была дана рекомендация не проводить биопсию в случаях, когда речь идет о типичных внутренних глиомах моста.
В то время риск вреда от биопсии еще не был хорошо известен, поскольку технология стереотаксической биопсии была еще относительно новой. Но поскольку польза от биопсии так мала, риски были слишком велики, чтобы ее проводить. На основании этих исторических данных был принят стандарт лечения, согласно которому биопсию при опухолях DIPG делать не нужно.
Когда нейрохирург, онколог и радиолог сходятся во мнении, что опухоль не похожа на типичную DIPG, считается целесообразным провести биопсию. После публикации исследования CCG 9928 во многих других публикациях была подтверждена безопасность стереотаксической биопсии в задней черепной ямке с относительно небольшим количеством причиненного вреда. Таким образом, решение о проведении биопсии основывается на том, является ли опухоль настолько атипичной, что можно рассматривать другой диагноз. Кроме того, некоторые опухоли, по мнению хирурга, онколога и радиолога, остаются настолько необычными, что более целесообразной является открытая операция (удаление лоскута черепа и проникновение в ткани мозга инструментами, превышающими по размеру иглу).
Федеральные рекомендации по проведению клинических исследований
Федеральные рекомендации по проведению исследований, особенно на детях, предусматривают, что процедура, связанная с более чем минимальным риском, должна быть полезна для конкретного ребенка. Какова польза от проведения процедуры; позволит ли она лучше понять природу опухоли; принесет ли она пользу конкретному ребенку? Как мы должны оценивать пользу? Если ребенок и его семья решат, что помощь в расширении знаний - это очень значительная польза для него, достаточно ли это существенно, чтобы компенсировать мнение о том, что, поскольку «выживаемость ребенка не изменится», потенциальной пользы нет? Это главный вопрос, на который нет простых ответов.
Оригинал статьи здесь.
Лечение гидроцефалии
Гидроцефалия - это медицинское состояние, характеризующееся накоплением спинномозговой жидкости (СМЖ) в полостях головного мозга, что приводит к повышению внутричерепного давления. Спинномозговая жидкость - это прозрачная, бесцветная жидкость, которая окружает и защищает головной и спинной мозг, обеспечивая его необходимыми питательными веществами и удаляя отработанные продукты.
По мере роста опухолей DIPG/DMG они могут иногда блокировать поток СМЖ, вызывая гидроцефалию. Иногда детям с DIPG/DMG требуются процедуры для контроля давления жидкости.
Симптомы гидроцефалии
Когда давление жидкости повышается, это может вызвать головные боли, рвоту, изменения психики и даже кому. Многие из этих симптомов совпадают с типичными при DIPG/DMG.
Вентрикулоперитонеальный шунт (VP-шунт)
Наиболее распространенной и хорошо зарекомендовавшей себя процедурой лечения гидроцефалии является вентрикулоперитонеальный шунт (VP-шунт). Трубка прокладывается от внешней поверхности головы через череп и мозг в боковой желудочек. Шунт соединен с устройством - клапаном (клапан может быть программируемым или нет. Обязательно уточните у нейрохирурга тип клапана, так как например, при введении лекарств в резервуар Оммайя может потребоваться перекрытие шунта на время введения), который определяет, какое давление должно создаться, чтобы СМЖ начала вытекать, и следит за тем, чтобы СМЖ вытекала только из желудочка, а не попадала обратно. Клапан располагается под кожей и соединяется с трубкой, которая ведет к месту в организме, где ЦСЖ может всасываться обратно в кровоток (куда бы она попала из мозга напрямую, если бы могла). Чаще всего конечной точкой шунтов является брюшинная полость - живот, но в других случаях шунты проходят в грудную клетку, по кровеносным сосудам к сердцу или даже к желчному пузырю. Эффективные шунты существуют уже около 50 лет, и каждый год они спасают и улучшают жизнь десяткам тысяч детей.
Однако у шунтов есть свои проблемы. Они чужеродны для организма, поэтому тело может реагировать на них и блокировать их прохождение. Кроме того, это механические системы, которые могут сломаться или выйти из строя. Чаще всего они становятся проблемой, когда в них попадает инфекция. Инфекции происходят от 5 до 14 процентов случаев их имплантации. (Нейрохирурги уделяют большое внимание тому, как снизить количество таких инфекций). Если шунт инфицирован, его приходится удалять, а через некоторое время заменять чистой системой.
Оригинал статьи здесь.
По мере роста опухолей DIPG/DMG они могут иногда блокировать поток СМЖ, вызывая гидроцефалию. Иногда детям с DIPG/DMG требуются процедуры для контроля давления жидкости.
Симптомы гидроцефалии
Когда давление жидкости повышается, это может вызвать головные боли, рвоту, изменения психики и даже кому. Многие из этих симптомов совпадают с типичными при DIPG/DMG.
Вентрикулоперитонеальный шунт (VP-шунт)
Наиболее распространенной и хорошо зарекомендовавшей себя процедурой лечения гидроцефалии является вентрикулоперитонеальный шунт (VP-шунт). Трубка прокладывается от внешней поверхности головы через череп и мозг в боковой желудочек. Шунт соединен с устройством - клапаном (клапан может быть программируемым или нет. Обязательно уточните у нейрохирурга тип клапана, так как например, при введении лекарств в резервуар Оммайя может потребоваться перекрытие шунта на время введения), который определяет, какое давление должно создаться, чтобы СМЖ начала вытекать, и следит за тем, чтобы СМЖ вытекала только из желудочка, а не попадала обратно. Клапан располагается под кожей и соединяется с трубкой, которая ведет к месту в организме, где ЦСЖ может всасываться обратно в кровоток (куда бы она попала из мозга напрямую, если бы могла). Чаще всего конечной точкой шунтов является брюшинная полость - живот, но в других случаях шунты проходят в грудную клетку, по кровеносным сосудам к сердцу или даже к желчному пузырю. Эффективные шунты существуют уже около 50 лет, и каждый год они спасают и улучшают жизнь десяткам тысяч детей.
Однако у шунтов есть свои проблемы. Они чужеродны для организма, поэтому тело может реагировать на них и блокировать их прохождение. Кроме того, это механические системы, которые могут сломаться или выйти из строя. Чаще всего они становятся проблемой, когда в них попадает инфекция. Инфекции происходят от 5 до 14 процентов случаев их имплантации. (Нейрохирурги уделяют большое внимание тому, как снизить количество таких инфекций). Если шунт инфицирован, его приходится удалять, а через некоторое время заменять чистой системой.
Оригинал статьи здесь.
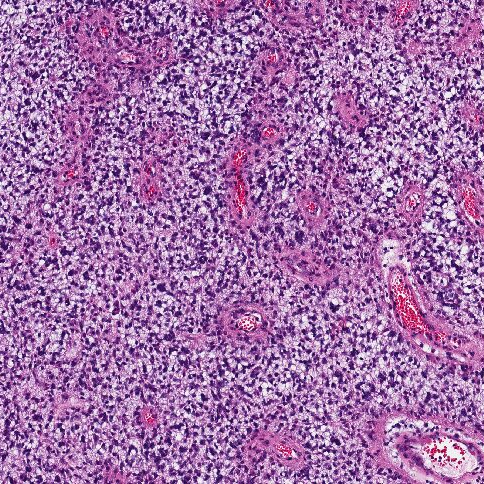
Иммуногистохимия (ИГХ)
Иммуногистохимия (ИГХ) — это важный метод диагностики, который используется для изучения биологических характеристик опухоли, включая экспрессию специфических белков, что помогает уточнить диагноз и определить возможные мишени для терапии.
Роль иммуногистохимии при DIPG:
Иммуногистохимия позволяет визуализировать наличие специфических белков в тканях опухоли с помощью антител, меченных красителями. Это помогает:
H3K27M:
Роль BRAF в опухолях мозга:
Дифференциальная диагностика:
Процесс проведения иммуногистохимии:
Забор ткани:
Иммуногистохимия, в сочетании с другими методами (например, молекулярной генетикой), продолжает играть важную роль в изучении DIPG и разработке новых подходов к лечению. Например, исследования мутации H3K27M открывают возможности для разработки эпигенетической терапии.
Текст подготовлен с помощью ИИ DeepSeek.
Роль иммуногистохимии при DIPG:
Иммуногистохимия позволяет визуализировать наличие специфических белков в тканях опухоли с помощью антител, меченных красителями. Это помогает:
- Подтвердить диагноз DIPG.
- Определить молекулярные характеристики опухоли.
- Выявить потенциальные мишени для таргетной терапии.
H3K27M:
- Мутация в гене гистона H3 (H3K27M) является ключевой молекулярной особенностью DIPG.Она обнаруживается примерно в 80% случаев.
- ИГХ с антителами к мутантному гистону H3K27M позволяет подтвердить наличие этой мутации.
- Мутация H3K27M связана с плохим прогнозом.
- Белок p53 является опухолевым супрессором. Мутации в гене TP53 часто встречаются при DIPG.
- ИГХ может показать накопление мутантного белка p53 в опухолевых клетках.
- Рецептор эпидермального фактора роста (EGFR) часто гиперэкспрессируется в опухолях DIPG.
- ИГХ помогает выявить уровень экспрессии EGFR, что может быть полезно для выбора таргетной терапии.
- Рецептор фактора роста тромбоцитов (PDGFRA) также часто гиперэкспрессируется или мутирует при DIPG.
- ИГХ может показать уровень экспрессии PDGFRA.
- Маркер пролиферативной активности опухоли. Высокий уровень Ki-67 указывает на быстрый рост опухоли.
- Глиальный фибриллярный кислый белок (GFAP) используется для подтверждения глиального происхождения опухоли.
Роль BRAF в опухолях мозга:
- Ген BRAF кодирует белок, участвующий в сигнальном пути MAPK/ERK, который регулирует рост и деление клеток.
- Мутации в гене BRAF (например, BRAF V600E) часто встречаются при других типах глиом, таких как пилоцитарная астроцитома или ганглиоглиома, а также при некоторых других опухолях мозга.
Дифференциальная диагностика:
- Если есть сомнения в диагнозе DIPG, исследование BRAF может помочь отличить его от других опухолей, таких как пилоцитарная астроцитома, которая часто имеет мутацию BRAF V600E.
- В редких случаях DIPG может иметь атипичные молекулярные характеристики, включая мутации BRAF.
- Если мутация BRAF обнаружена, это может открыть возможности для таргетной терапии ингибиторами BRAF (например, вемурафениб, дабрафениб).
Процесс проведения иммуногистохимии:
Забор ткани:
- Биопсия опухоли (обычно стереотаксическая) проводится для получения образца ткани.
- Ткань фиксируется и нарезается на тонкие срезы.
- Срезы обрабатываются специфическими антителами, которые связываются с целевыми белками.
- Под микроскопом оценивается наличие и интенсивность окрашивания, что указывает на уровень экспрессии маркеров.
- Уточнение диагноза: ИГХ помогает отличить DIPG от других опухолей ствола мозга.
- Прогностическая информация: Например, наличие мутации H3K27M связано с более агрессивным течением.
- Выбор терапии: ИГХ может выявить мишени для таргетной терапии (например, EGFR или PDGFRA).
- DIPG расположена в труднодоступной области мозга, что делает биопсию рискованной процедурой.
- ИГХ требует высококачественного образца ткани и специализированного оборудования.
Иммуногистохимия, в сочетании с другими методами (например, молекулярной генетикой), продолжает играть важную роль в изучении DIPG и разработке новых подходов к лечению. Например, исследования мутации H3K27M открывают возможности для разработки эпигенетической терапии.
Текст подготовлен с помощью ИИ DeepSeek.
Молекулярно-генетические исследования
Молекулярно-генетические исследования играют ключевую роль в диагностике, классификации и выборе терапии при диффузной внутренней глиоме моста (DIPG). Эти исследования позволяют выявить специфические генетические и эпигенетические изменения, которые характерны для DIPG и могут влиять на прогноз и лечение.
Основные молекулярные изменения при DIPG:
Мутация в гене гистона H3 (H3K27M):
Методы молекулярно-генетических исследований:
Секвенирование ДНК:
Значение молекулярно-генетических исследований:
Диагностика и классификация:
Молекулярно-генетические исследования являются важным инструментом для понимания биологии DIPG и разработки персонализированных подходов к лечению. Они помогают не только уточнить диагноз, но и определить потенциальные мишени для терапии, что особенно важно при таком агрессивном заболевании, как DIPG.
Текст подготовлен с помощью ИИ DeepSeek.
Основные молекулярные изменения при DIPG:
Мутация в гене гистона H3 (H3K27M):
- Встречается примерно в 80% случаев DIPG.
- Мутация затрагивает гены H3F3A или HIST1H3B/C, кодирующие гистон H3.
- Приводит к нарушению регуляции генов через изменение эпигенетического ландшафта (снижение уровня метилирования H3K27me3).
- Связана с более агрессивным течением и плохим прогнозом.
- TP53 — ген-супрессор опухолей, который регулирует клеточный цикл и апоптоз.
- Мутации в TP53 часто встречаются при DIPG и ассоциированы с устойчивостью к терапии.
- Рецептор фактора роста тромбоцитов (PDGFRA) часто гиперэкспрессируется или мутирует при DIPG.
- Это способствует активации сигнальных путей, стимулирующих рост опухоли.
- Часто наблюдается при DIPG и способствует выживанию и росту опухолевых клеток.
- Встречаются примерно в 20-25% случаев DIPG.
- ACVR1 кодирует рецептор активина, который участвует в регуляции роста клеток.
- Амплификация или мутации в гене EGFR.
- Изменения в генах, регулирующих клеточный цикл (например, CDKN2A).
Методы молекулярно-генетических исследований:
Секвенирование ДНК:
- Полногеномное секвенирование (WGS) или секвенирование экзома (WES) для выявления мутаций и амплификаций.
- Целевое секвенирование (например, панели генов) для анализа ключевых генов, таких как H3F3A, TP53, PDGFRA, ACVR1.
- Исследование уровня метилирования ДНК и гистонов (например, H3K27me3).
- Используется для подтверждения мутации H3K27M и изучения эпигенетических изменений.
- Позволяет выявить амплификации или делеции генов (например, PDGFRA, EGFR).
- Используется для анализа экспрессии генов и выявления химерных транскриптов (например, при амплификации PDGFRA).
- Иммуногистохимия (ИГХ):
- Хотя это не молекулярно-генетический метод, ИГХ используется для выявления белков, связанных с генетическими изменениями (например, мутантный H3K27M, p53).
Значение молекулярно-генетических исследований:
Диагностика и классификация:
- Позволяют точно определить тип опухоли и ее молекулярные характеристики.
- Например, наличие мутации H3K27M является ключевым диагностическим критерием для DIPG.
- Некоторые мутации (например, H3K27M, TP53) связаны с более агрессивным течением и худшим прогнозом.
- Молекулярные изменения могут быть мишенями для таргетной терапии. Например:
- Ингибиторы PDGFRA (например, дазатиниб).
- Ингибиторы PI3K/AKT/mTOR (например, эверолимус).
- Эпигенетическая терапия (например, ингибиторы EZH2 или BET-белков).
- Молекулярные данные помогают разрабатывать новые методы лечения и отбирать пациентов для клинических испытаний.
- Ингибиторы PDGFRA: для опухолей с амплификацией или мутациями в PDGFRA.
- Ингибиторы BRAF: если обнаружена мутация BRAF V600E (редко при DIPG).
- Эпигенетические препараты: для опухолей с мутацией H3K27M.
Молекулярно-генетические исследования являются важным инструментом для понимания биологии DIPG и разработки персонализированных подходов к лечению. Они помогают не только уточнить диагноз, но и определить потенциальные мишени для терапии, что особенно важно при таком агрессивном заболевании, как DIPG.
Текст подготовлен с помощью ИИ DeepSeek.
FoundationOne CDx (через Фонд Хабенского)
FoundationOne CDx — это комплексный геномный тест, разработанный компанией Foundation Medicine, который используется для анализа молекулярных изменений в опухолях. Он предоставляет информацию о мутациях, амплификациях, делециях и других генетических изменениях, которые могут быть полезны для выбора таргетной терапии. В случае диффузной внутренней глиомы моста (DIPG) FoundationOne CDx может быть использован для выявления ключевых молекулярных особенностей опухоли.
Что такое FoundationOne CDx?
DIPG — это агрессивная опухоль мозга, которая часто характеризуется специфическими генетическими изменениями, такими как мутация H3K27M. FoundationOne CDx может помочь:
Выявить ключевые мутации:
FoundationOne CDx представляет собой мощный инструмент для молекулярной характеристики DIPG и выбора персонализированной терапии. Однако его применение должно быть обоснованным и согласованным с лечащим врачом, особенно с учетом сложности биопсии и ограниченной доступности теста.
Текст подготовлен с помощью ИИ DeepSeek.
Что такое FoundationOne CDx?
- Тип теста: Геномный анализ на основе секвенирования нового поколения (NGS).
- Материал: Опухолевая ткань (биопсия) или кровь (жидкостная биопсия).
- Охват: Анализирует более 300 генов, связанных с раком, а также микросателлитную нестабильность (MSI) и опухолевую мутационную нагрузку (TMB).
DIPG — это агрессивная опухоль мозга, которая часто характеризуется специфическими генетическими изменениями, такими как мутация H3K27M. FoundationOne CDx может помочь:
Выявить ключевые мутации:
- H3K27M: Мутация в гене гистона H3, характерная для DIPG.
- TP53: Мутации в гене-супрессоре опухолей.
- PDGFRA: Амплификации или мутации в гене рецептора фактора роста тромбоцитов.
- ACVR1: Мутации в гене рецептора активина.
- PI3K/AKT/mTOR: Изменения в генах, связанных с этим сигнальным путем.
- Например, мутации в PDGFRA могут быть мишенью для ингибиторов тирозинкиназ (например, дазатиниб).
- Изменения в PI3K/AKT/mTOR пути могут быть мишенью для ингибиторов mTOR (например, эверолимус).
- TMB может быть полезен для оценки потенциальной чувствительности к иммунотерапии, хотя при DIPG это менее актуально из-за низкой иммуногенности опухоли.
- MSI может указывать на потенциальную чувствительность к иммунотерапии, но при DIPG это редко.
- Комплексный анализ: Позволяет выявить широкий спектр генетических изменений.
- Персонализированный подход: Помогает подобрать таргетную терапию на основе молекулярных особенностей опухоли.
- Поддержка клинических решений: Результаты теста могут быть использованы для выбора терапии, особенно в сложных или рецидивирующих случаях.
- Доступность: Тест может быть дорогостоящим и не всегда доступным во всех регионах.
- Необходимость образца ткани: Для анализа требуется биопсия опухоли, что при DIPG может быть сложным из-за расположения опухоли в стволе мозга.
- Ограниченная эффективность иммунотерапии: При DIPG иммунотерапия часто менее эффективна из-за низкой иммуногенности опухоли.
- Биопсия опухоли: Получение образца ткани для анализа.
- Геномный анализ: Проведение теста FoundationOne CDx.
- Интерпретация результатов:
- Выявление мутации H3K27M, амплификации PDGFRA или других изменений.
- Назначение таргетных препаратов (например, ингибиторов PDGFRA или mTOR).
- Участие в клинических испытаниях, основанных на молекулярных данных.
FoundationOne CDx представляет собой мощный инструмент для молекулярной характеристики DIPG и выбора персонализированной терапии. Однако его применение должно быть обоснованным и согласованным с лечащим врачом, особенно с учетом сложности биопсии и ограниченной доступности теста.
Текст подготовлен с помощью ИИ DeepSeek.
Тем временем в России..
Ответы на вопросы от нейрохирурга Матвея Игоревича Лившица
1. Как простыми словами объяснить понятие «операбельности»/ «неоперабельности» при диффузной внутренней глиоме моста (DIPG)
2. В какой ситуации при диффузной внутренней глиоме моста (DIPG) частичная резекция должна рассматриваться как первоначальный вариант лечения? (Например, диффузная опухоль с узловым компонентом, на МРТ выявляется участок опухоли, вызывающий масс-эффект (смещение и сдавление прилежащих структур), который может накапливать контрастное вещество)
3. Какие могут быть объективные противопоказания для выполнения стереотаксической биопсии при диффузной внутренней глиоме моста (DIPG)?
4. У какого процента пациентов ухудшается неврологический статус после проведенной стереотаксической биопсии при DIPG?
5. Какова вероятность получить неиформативные результаты биопсии?
6. Должен ли рассматриваться вариант повторной хирургической резекции при рецидиве с целью уменьшения неврологического дефицита, связанного именно с масс-эффектом опухоли? Либо неврологический дефицит пациента связан исключительно с продолженным ростом диффузной части опухоли, не подлежащей резекции?
Лившиц М.И. (2016–2023 г. — заведующий отделением нейрохирургии, врач-нейрохирург в Морозовской детской городской клинической больнице Департамента здравоохранения г. Москвы.):
Под операбельностью, на современном этапе развития нейрохирургии, принято понимать хирургическое вмешательство, при котором имеется возможность удаления значительной части опухоли. Хирургические доступы в нейрохирургии разработаны для всех анатомических зон головного мозга, в каждой из которых могут располагаться опухоли. Т.е. недоступных для хирургии опухолей нет. Однако, для диффузных, т.е. без четких границ, опухолей ствола головного мозга (DIPG), в котором расположены все 12 пар ядер черепных нервов, центры регуляции глотания, артикуляции, дыхания и кровообращения, а также нервные пучки, которые обеспечивают пациенту возможность работы всех мышц и все виды чувствительности (зрение, слух, обоняние, осязание, температурные и болевые ощущения , чувство равновесия и координации), а сами опухоли не имеют четких границ и находятся рядом и/или между перечисленными анатомическими структурами, стремление врача к удалению какого-либо значимого объема такой опухоли нецелесообразно, потому что может привести к серьезным проблемам во время операции и в послеоперационном периоде и как следствие к ситуации, в которой другие виды противоопухолевого лечения не смогут быть применены. Такое положение вещей обозначается сегодня термином неоперабельной опухоли.
С другой стороны в последнее время золотым стандартом в лечении диффузных опухолей ствола головного мозга становится получение биопсийного материала из новообразования до начала других видов противоопухолевого лечения (лучевая терапия, химиотерапия) для проведения морфологических, иммуногистохимических и молекулярно-генетических исследований ткани опухоли с целью получить возможности для инновационных методов лечения (таргетная терапия, индивидуальная вакцинотерапия, терапия онколитическими вирусами и др).
Задача по получению биопсийного материала из ткани опухоли может быть решена с помощью или минимально инвазивной стереотаксической игольчатой биопсии в условиях применения нейронавигации (такое вмешательство выполняется в операционной) или с помощью открытого нейрохирургического доступа к опухоли ствола головного мозга. Открытая биопсия может рассматриваться как опция в случае, если имеется распространение опухоли ствола головного мозга с выходом новообразования в полость 4го желудочка (так называемый экзофитный рост опухоли в полость 4го желудочка) или с выходом ее в парастволовое пространство. Открытая биопсия позволяет получить больше биопсийного материала и надежнее контролировать гемостаз по ходу операции по сравнению с стереотаксической биопсией, потому что открытую биопсию нейрохирург выполняет под контролем взгляда через операционный микроскоп, непосредственно визуализируя новообразование и анатомические структуры головного мозга, а
стереотаксическую пункционную биопсию нейрохирург проводит по нейронавигационной траектории без непосредственной визуализации опухоли и структур мозга. Выбор вида операции - биопсии происходит на консилиуме с участием: нейроонколога, нейрохирурга и врача лучевой диагностики.
Проблемы стереотаксической биопсии:
- неинформативная биопсия (т.е. гистологическое строение опухоли определить не удалось из-за малого количества материала или из-за того, что пункционная игла оказалась в ткани мозга рядом с опухолью) – 5 – 7 -10%
- кровоизлияние в ткань опухоли – 3 – 5%
- отек опухоли и ствола головного мозга – 3- 5%
- ухудшение неврологического статуса пациента – 3 – 5%
Абсолютных противопоказаний к стереотаксической биопсии нет, могут быть относительные:
например низкий статус пациента по шкале Карновского на момент первичной диагностики новообразования, сопутствующие заболевания, сложность определения траектории биопсии и другие.
Вопрос уменьшения масс-эффекта опухоли ствола головного мозга с помощью резекции ее значительной части практически не рассматривается ни в момент первичной диагностики, ни в момент продолженного роста опухоли. Иногда с целью стабилизации объемных взаимоотношений в области задней черепной ямки, там где располагается опухоль ствола мозга, рассматривается вопрос о декомпрессивной субокципитальной краниоэктомии (удалении части затылочной кости и задней дужки 1го шейного позвонка) с пластикой твердой мозговой оболочки в области краниовертебрального перехода. Часть пациентов, у которых опухоль приводит к развитию гидроцефалии, нуждается в проведении ликворошунтирующей операции: чаще имплантация вентрикулоперитонеального шунта и значительно реже нейроэндоскопическая тривентрикулостомия.
2. В какой ситуации при диффузной внутренней глиоме моста (DIPG) частичная резекция должна рассматриваться как первоначальный вариант лечения? (Например, диффузная опухоль с узловым компонентом, на МРТ выявляется участок опухоли, вызывающий масс-эффект (смещение и сдавление прилежащих структур), который может накапливать контрастное вещество)
3. Какие могут быть объективные противопоказания для выполнения стереотаксической биопсии при диффузной внутренней глиоме моста (DIPG)?
4. У какого процента пациентов ухудшается неврологический статус после проведенной стереотаксической биопсии при DIPG?
5. Какова вероятность получить неиформативные результаты биопсии?
6. Должен ли рассматриваться вариант повторной хирургической резекции при рецидиве с целью уменьшения неврологического дефицита, связанного именно с масс-эффектом опухоли? Либо неврологический дефицит пациента связан исключительно с продолженным ростом диффузной части опухоли, не подлежащей резекции?
Лившиц М.И. (2016–2023 г. — заведующий отделением нейрохирургии, врач-нейрохирург в Морозовской детской городской клинической больнице Департамента здравоохранения г. Москвы.):
Под операбельностью, на современном этапе развития нейрохирургии, принято понимать хирургическое вмешательство, при котором имеется возможность удаления значительной части опухоли. Хирургические доступы в нейрохирургии разработаны для всех анатомических зон головного мозга, в каждой из которых могут располагаться опухоли. Т.е. недоступных для хирургии опухолей нет. Однако, для диффузных, т.е. без четких границ, опухолей ствола головного мозга (DIPG), в котором расположены все 12 пар ядер черепных нервов, центры регуляции глотания, артикуляции, дыхания и кровообращения, а также нервные пучки, которые обеспечивают пациенту возможность работы всех мышц и все виды чувствительности (зрение, слух, обоняние, осязание, температурные и болевые ощущения , чувство равновесия и координации), а сами опухоли не имеют четких границ и находятся рядом и/или между перечисленными анатомическими структурами, стремление врача к удалению какого-либо значимого объема такой опухоли нецелесообразно, потому что может привести к серьезным проблемам во время операции и в послеоперационном периоде и как следствие к ситуации, в которой другие виды противоопухолевого лечения не смогут быть применены. Такое положение вещей обозначается сегодня термином неоперабельной опухоли.
С другой стороны в последнее время золотым стандартом в лечении диффузных опухолей ствола головного мозга становится получение биопсийного материала из новообразования до начала других видов противоопухолевого лечения (лучевая терапия, химиотерапия) для проведения морфологических, иммуногистохимических и молекулярно-генетических исследований ткани опухоли с целью получить возможности для инновационных методов лечения (таргетная терапия, индивидуальная вакцинотерапия, терапия онколитическими вирусами и др).
Задача по получению биопсийного материала из ткани опухоли может быть решена с помощью или минимально инвазивной стереотаксической игольчатой биопсии в условиях применения нейронавигации (такое вмешательство выполняется в операционной) или с помощью открытого нейрохирургического доступа к опухоли ствола головного мозга. Открытая биопсия может рассматриваться как опция в случае, если имеется распространение опухоли ствола головного мозга с выходом новообразования в полость 4го желудочка (так называемый экзофитный рост опухоли в полость 4го желудочка) или с выходом ее в парастволовое пространство. Открытая биопсия позволяет получить больше биопсийного материала и надежнее контролировать гемостаз по ходу операции по сравнению с стереотаксической биопсией, потому что открытую биопсию нейрохирург выполняет под контролем взгляда через операционный микроскоп, непосредственно визуализируя новообразование и анатомические структуры головного мозга, а
стереотаксическую пункционную биопсию нейрохирург проводит по нейронавигационной траектории без непосредственной визуализации опухоли и структур мозга. Выбор вида операции - биопсии происходит на консилиуме с участием: нейроонколога, нейрохирурга и врача лучевой диагностики.
Проблемы стереотаксической биопсии:
- неинформативная биопсия (т.е. гистологическое строение опухоли определить не удалось из-за малого количества материала или из-за того, что пункционная игла оказалась в ткани мозга рядом с опухолью) – 5 – 7 -10%
- кровоизлияние в ткань опухоли – 3 – 5%
- отек опухоли и ствола головного мозга – 3- 5%
- ухудшение неврологического статуса пациента – 3 – 5%
Абсолютных противопоказаний к стереотаксической биопсии нет, могут быть относительные:
например низкий статус пациента по шкале Карновского на момент первичной диагностики новообразования, сопутствующие заболевания, сложность определения траектории биопсии и другие.
Вопрос уменьшения масс-эффекта опухоли ствола головного мозга с помощью резекции ее значительной части практически не рассматривается ни в момент первичной диагностики, ни в момент продолженного роста опухоли. Иногда с целью стабилизации объемных взаимоотношений в области задней черепной ямки, там где располагается опухоль ствола мозга, рассматривается вопрос о декомпрессивной субокципитальной краниоэктомии (удалении части затылочной кости и задней дужки 1го шейного позвонка) с пластикой твердой мозговой оболочки в области краниовертебрального перехода. Часть пациентов, у которых опухоль приводит к развитию гидроцефалии, нуждается в проведении ликворошунтирующей операции: чаще имплантация вентрикулоперитонеального шунта и значительно реже нейроэндоскопическая тривентрикулостомия.
02
ЛУЧЕВАЯ ТЕРАПИЯ
Лучевая терапия при диффузных внутренних глиомах моста (DIPG)
Лучевая терапия является стандартным методом лечения детей с диффузными внутренними глиомами моста (DIPG). При этом виде терапии используются высокоэнергетические рентгеновские лучи, аналогичные тем, что применяются в компьютерной томографии (КТ), но в гораздо более высоких дозах. Эти рентгеновские лучи накапливают энергию внутри опухоли, вызывая повреждение ДНК клеток. Опухолевые клетки не в состоянии восстановить повреждения и в конечном итоге погибают при попытке деления.
Процесс лучевой терапии
Прежде чем начать облучение, родители ребенка с DIPG консультируются с радиологом, чтобы обсудить планируемую терапию и возможные побочные эффекты. После этой первичной консультации ребенок проходит сеанс планирования (также называемый "разметкой"). В это время для ребенка будет изготовлена индивидуальная маска. Маска позволяет точно и последовательно позиционировать голову для каждой процедуры и помогает ребенку сохранять неподвижность во время лечения. Маска изготавливается из особого вида пластика, который поддается формовке при нагревании на водяной бане. После того как маска готова, проводится специальная компьютерная томография. Весь процесс занимает около 1 часа.
После сеанса планирования радиолог с помощью КТ (наиболее точно с помощью свежего МРТ) определяет область, соответствующую опухоли, и участки мозга, которые не должны получать облучение. С помощью дозиметристов (они специализируются на расчете дозы облучения, чтобы опухоль получила достаточное количество радиации) и физиков (они разрабатывают и руководят программами контроля качества радиационного оборудования и процедур) разрабатывается план лучевой терапии, направленный на максимальное лечение опухоли при минимальном количестве радиации, поступающей в нормальные ткани мозга и окружающие ткани.
Лучевая терапия проводится ежедневно, с понедельника по пятницу, в течение примерно 6 недель в общей дозе около 54 Грей (Гр). Более мелкие ежедневные фракции, накапливающиеся до общей дозы в течение нескольких недель, предназначены для того, чтобы дать нормальным тканям возможность восстановить некоторые повреждения ДНК, вызванные радиацией, и при этом уничтожить опухоль.
Поскольку пациенты, проходящие облучение, должны лежать на столе неподвижно и в одиночестве, некоторые дети слишком малы или слишком больны, чтобы переносить лучевую терапию в бодрствующем состоянии. В таких случаях сеанс планирования и процедуры могут проводиться под общей анестезией. Обычно при лучевой терапии используется пропофол. Пропофол - это внутривенный анестетик, который обеспечивает быстрое введение и восстановление, а главное - не требует интубации (введения трубки) для защиты дыхательных путей. Даже при ежедневном применении риск осложнений при использовании пропофола очень низок. Как правило, ребенка приносят в палату в сознании, вместе с родителями, и начинают анестезию. После индукции анестезии родители покидают комнату, и проводятся процедуры лучевой терапии.
Эффективность лучевой терапии
Лучевая терапия - эффективное паллиативное лечение, которое улучшает симптомы примерно у 80 % детей с DIPG и продлевает их жизнь на 2-3 месяца. Доза лучевой терапии ограничена толерантностью окружающей нормальной ткани мозга. Однако, учитывая высокую частоту ответов, в 1980-х годах ряд учреждений увеличили дозу лучевой терапии с 54 Гр до более чем 70 Гр и получили многообещающие предварительные результаты. Для увеличения дозы облучения использовались меньшие дозы на курс лечения (так называемое гиперфракционирование). Такие меньшие дозы позволяют лучше восстанавливать нормальные ткани, а значит, можно получить большую суммарную дозу. Однако рандомизированное исследование, проведенное Педиатрической онкологической группой, показало, что, хотя большая доза облучения хорошо переносится большинством детей, разницы в выживаемости, к сожалению, нет.
Медики заинтересованы в изучении средств, которые можно вводить вместе с радиацией для улучшения эффекта этой терапии; эти средства называются радиосенсибилизаторами. Некоторые виды химиотерапии, например карбоплатин, могут использоваться в качестве радиосенсибилизаторов. Изучаются и другие экспериментальные средства. Например, триоксид мышьяка, принимаемый одновременно с лучевой терапией, проходит клинические испытания для определения безопасности и получения информации, которая может быть использована для изучения эффективности.
Возможные осложнения при лучевой терапии
Распространенным осложнением лучевой терапии у детей с DIPG является радиационный некроз - гибель клеток мозговой ткани. Это может вызвать отек и потенциально привести к неврологическим симптомам, таким как головная боль, тошнота, рвота, черепные невропатии и атаксия (потеря координации мышечных движений). Лучевой некроз бывает очень трудно отличить от рецидива опухоли по клиническим симптомам или по результатам визуализации. Для симптоматического лечения радиационного некроза обычно используются стероиды. Однако стероиды могут вызывать побочные эффекты, включая проблемы с поведением, бессонницу и увеличение веса. Эти осложнения, связанные со стероидами, могут существенно повлиять на качество жизни ребенка. Точный механизм радиационного некроза изучен плохо, но, по-видимому, определенную роль играет фактор роста эндотелия сосудов (VEGF). Бевацизумаб (Авастин) - моноклональное антитело, препятствующее действию VEGF, и в настоящее время изучается (и широко используется, например в РНЦРР) как возможный метод лечения лучевого некроза.
Оригинал статьи здесь.
Процесс лучевой терапии
Прежде чем начать облучение, родители ребенка с DIPG консультируются с радиологом, чтобы обсудить планируемую терапию и возможные побочные эффекты. После этой первичной консультации ребенок проходит сеанс планирования (также называемый "разметкой"). В это время для ребенка будет изготовлена индивидуальная маска. Маска позволяет точно и последовательно позиционировать голову для каждой процедуры и помогает ребенку сохранять неподвижность во время лечения. Маска изготавливается из особого вида пластика, который поддается формовке при нагревании на водяной бане. После того как маска готова, проводится специальная компьютерная томография. Весь процесс занимает около 1 часа.
После сеанса планирования радиолог с помощью КТ (наиболее точно с помощью свежего МРТ) определяет область, соответствующую опухоли, и участки мозга, которые не должны получать облучение. С помощью дозиметристов (они специализируются на расчете дозы облучения, чтобы опухоль получила достаточное количество радиации) и физиков (они разрабатывают и руководят программами контроля качества радиационного оборудования и процедур) разрабатывается план лучевой терапии, направленный на максимальное лечение опухоли при минимальном количестве радиации, поступающей в нормальные ткани мозга и окружающие ткани.
Лучевая терапия проводится ежедневно, с понедельника по пятницу, в течение примерно 6 недель в общей дозе около 54 Грей (Гр). Более мелкие ежедневные фракции, накапливающиеся до общей дозы в течение нескольких недель, предназначены для того, чтобы дать нормальным тканям возможность восстановить некоторые повреждения ДНК, вызванные радиацией, и при этом уничтожить опухоль.
Поскольку пациенты, проходящие облучение, должны лежать на столе неподвижно и в одиночестве, некоторые дети слишком малы или слишком больны, чтобы переносить лучевую терапию в бодрствующем состоянии. В таких случаях сеанс планирования и процедуры могут проводиться под общей анестезией. Обычно при лучевой терапии используется пропофол. Пропофол - это внутривенный анестетик, который обеспечивает быстрое введение и восстановление, а главное - не требует интубации (введения трубки) для защиты дыхательных путей. Даже при ежедневном применении риск осложнений при использовании пропофола очень низок. Как правило, ребенка приносят в палату в сознании, вместе с родителями, и начинают анестезию. После индукции анестезии родители покидают комнату, и проводятся процедуры лучевой терапии.
Эффективность лучевой терапии
Лучевая терапия - эффективное паллиативное лечение, которое улучшает симптомы примерно у 80 % детей с DIPG и продлевает их жизнь на 2-3 месяца. Доза лучевой терапии ограничена толерантностью окружающей нормальной ткани мозга. Однако, учитывая высокую частоту ответов, в 1980-х годах ряд учреждений увеличили дозу лучевой терапии с 54 Гр до более чем 70 Гр и получили многообещающие предварительные результаты. Для увеличения дозы облучения использовались меньшие дозы на курс лечения (так называемое гиперфракционирование). Такие меньшие дозы позволяют лучше восстанавливать нормальные ткани, а значит, можно получить большую суммарную дозу. Однако рандомизированное исследование, проведенное Педиатрической онкологической группой, показало, что, хотя большая доза облучения хорошо переносится большинством детей, разницы в выживаемости, к сожалению, нет.
Медики заинтересованы в изучении средств, которые можно вводить вместе с радиацией для улучшения эффекта этой терапии; эти средства называются радиосенсибилизаторами. Некоторые виды химиотерапии, например карбоплатин, могут использоваться в качестве радиосенсибилизаторов. Изучаются и другие экспериментальные средства. Например, триоксид мышьяка, принимаемый одновременно с лучевой терапией, проходит клинические испытания для определения безопасности и получения информации, которая может быть использована для изучения эффективности.
Возможные осложнения при лучевой терапии
Распространенным осложнением лучевой терапии у детей с DIPG является радиационный некроз - гибель клеток мозговой ткани. Это может вызвать отек и потенциально привести к неврологическим симптомам, таким как головная боль, тошнота, рвота, черепные невропатии и атаксия (потеря координации мышечных движений). Лучевой некроз бывает очень трудно отличить от рецидива опухоли по клиническим симптомам или по результатам визуализации. Для симптоматического лечения радиационного некроза обычно используются стероиды. Однако стероиды могут вызывать побочные эффекты, включая проблемы с поведением, бессонницу и увеличение веса. Эти осложнения, связанные со стероидами, могут существенно повлиять на качество жизни ребенка. Точный механизм радиационного некроза изучен плохо, но, по-видимому, определенную роль играет фактор роста эндотелия сосудов (VEGF). Бевацизумаб (Авастин) - моноклональное антитело, препятствующее действию VEGF, и в настоящее время изучается (и широко используется, например в РНЦРР) как возможный метод лечения лучевого некроза.
Оригинал статьи здесь.
Повторное облучение
Повторное облучение при опухолях головного мозга очень похоже на первоначальный опыт пациентов. Оно включает в себя тот же процесс планирования с моделированием на КТ и последующую ежедневную радиотерапию. Разница заключается, прежде всего, в дозе облучения, поскольку мозг никогда полностью не восстанавливается после первого лечения. Поэтому последующая лучевая терапия обычно связана с более высоким риском, чем первый курс.
Повторное облучение не является чем-то новым, однако в настоящее время оно применяется все чаще. Во многом это связано с увеличением опыта и данных, подтверждающих безопасность. Появилось множество публикаций, посвященных опухолям DIPG, DMG и медуллобластоме, а также другим внутричерепным опухолям, показывающих, что при соблюдении соответствующих мер предосторожности повторное облучение может быть проведено безопасно и с приемлемым риском.
Преимущества зависят от множества клинических факторов, таких как конкретный тип опухоли, время, прошедшее после первоначального лечения, и варианты адъювантной химиотерапии/иммунотерапии/таргетной терапии.
Оригинал статьи здесь.
Повторное облучение не является чем-то новым, однако в настоящее время оно применяется все чаще. Во многом это связано с увеличением опыта и данных, подтверждающих безопасность. Появилось множество публикаций, посвященных опухолям DIPG, DMG и медуллобластоме, а также другим внутричерепным опухолям, показывающих, что при соблюдении соответствующих мер предосторожности повторное облучение может быть проведено безопасно и с приемлемым риском.
Преимущества зависят от множества клинических факторов, таких как конкретный тип опухоли, время, прошедшее после первоначального лечения, и варианты адъювантной химиотерапии/иммунотерапии/таргетной терапии.
Оригинал статьи здесь.
Вопрос-ответ
Отвечает Василий Андреевич Григоренко, врач-радиотерапевт из Москвы
Василий Андреевич Григоренко - заведующий отделением, врач-радиотерапевт в НМИЦ им. Н,Н,Блохина.
1.Какое оптимальное время для начала лучевой терапии (ЛТ) после постановки диагноза DIPG по результатам МРТ?
Оптимальное время – чем быстрее, тем лучше. Пока нет симптоматики, пока есть нормальный соматический статус пациента нужно начинать лучевую терапию. Это обусловлено тем, что во время проведения ЛТ происходят определенные процессы, которые могут незначительно ухудшать соматический статус пациента на какой-то период. И логичнее использовать естественный компенсаторный резерв организма на возможные осложнения при ЛТ, чем на прогрессию заболевания с течением времени ожидания. Но вопрос о лучевой терапии безусловно должен решаться после консультации нейрохирурга и определения возможности выполнения биопсии и/или необходимости выполнения шунтирования.
2.Какое оптимальное время для начала лучевой терапии после операции при DIPG (стереотаксическая биопсия, открытая частичная резекция)?
Здесь все зависит от состояния пациента. В целом, если мы говорим об опыте операций на центральной-нервной системе, то возможно проведение ЛТ – через 2-4 недели после хирургического вмешательства, если оно было. Подготовку к ЛТ (например, КТ-топометрию) можно начинать заранее. Часто КТ-топометрию мы выполняем через 7-10 дней после операции. В обычном режиме ещё одна неделя уходила на расчеты программы ЛТ. За это время пациент полностью восстанавливался после операции и становится готовым к проведению ЛТ. Так же важно помнить, что в онкологии каждый пациент уникален, поэтому могут быть вариации.
3. Сколько времени в среднем требуется для начала ЛТ - от первой консультации у радиотерапевта до первой фракции ЛТ?
Этапы подготовки к ЛТ включают в себя: Консультацию; КТ-топометрию с изготовлением индивидуальных фиксирующих приспособлений; оконтуривание - на этом этапе подгружаются МРТ, ПЭТ-КТ (если есть); расчет программы лечения медицинскими физиками; проверка программы лечения (гарантия качества); старт лечения. В нормальном, рабочем режиме эти этапы занимают в среднем 3-5 рабочих дней. Это когда все делается спокойно, правильно и без спешки. Но бывают ситуации, когда пациенты поступают в тяжёлом соматическом статусе, с отрицательной динамикой и требуется срочное начало ЛТ. В таких случаях все силы бросаются на ускорение процессов подготовки и ЛТ может начинаться на следующий день, или даже день-в-день. Это не очень хорошая практика, которая не должна идти на потоке ввиду многих сложных аспектов проведения ЛТ, но при острой необходимости, такая возможность есть.
4. Какие исследования обязательны для выполнения (например, КТ, МРТ) перед процедурой расчетов и разметки? Какие рекомендуются дополнительно (ПЭТ-КТ?)
КТ-топометрия с фиксацией выполняется исключительно на базе учреждения, где пациент будет проходить ЛТ для того, что бы кривая КТ была внесена в планируюущую станцию для верности расчёта. Изготавливается специальная маска для фиксации головы. Специальной подготовки со стороны пациента не нужно, кроме тех случаев, когда у пациента много волос – их необходимо коротко постричь. Если пациенту проводилась операция, то требуется МРТ до операции и перед началом ЛТ. У нас в отделении правило, что МРТ-исследование при опухоли ЦНС не должно быть старше 3-4 недель до момента начала ЛТ. Некоторым пациентам мы делаем МРТ-топометрию на этапе подготовки к ЛТ, но большинству пациентов подгружаем обычное диагностическое МРТ, поэтому, чем ближе началу ЛТ оно выполнено, тем лучше. В идеале – 1-2 недели. Наши онкологи это знают, поэтому планируют МРТ таким образом, чтобы на следующий день после МРТ мы уже делаем КТ-топометрию. По поводу необходимости выполнения ПЭТ-КТ: есть опухоли ЦНС, для которых это делать нужно, но при DIPG это не актуально, так как это исследование не несет большой смысловой нагрузки при планировании и не будет влиять на подход к проведению ЛТ. Соответственно нет необходимости тратить на ПЭТ-КТ время. При DIPG в 99.9% случаях МРТ полностью отвечает нам, где опухоль распространяется.
5. Влияет ли молекулярно-генетический, или гистологический профиль опухоли на тактику проведения ЛТ, на сопроводительную терапию?
На сегодняшний день, увы, никак не влияет. Неважно на чём, когда и где вы облучаетесь – для ствола головного мозга стандарт будет 54 Грей в связи с ограничениями, которые накладывает данная локализация опухоли. Сопроводительная терапия обусловлена острыми реакциями на ЛТ – отечность, воспаление и т.д., Значит, при необходимости, будет проводится противоотечная терапия – тот же дексаметазон, либо диуретики. Так же будет влиять и статус пациента – от этого зависит интенсивность сопроводительной терапии.
6. Используются ли сегодня в России радиосенсибилизаторы при наличии образца опухоли?
Сейчас идут исследования, где используются различные препараты в качестве радиосенсибилизаторов при high-grade глиомах и диффузных опухолях ствола, но к сожалению, я не видел положительных результатов при DIPG (на осень 2024 года). На сегодняшний день стандартом является проведение лучевой терапии в монорежиме.
7. Какой на текущий момент оптимальный режим дозирования лучевой терапии в первой линии лечения DIPG?
При DIPG оптимальный стандартный режим - 54 Грей с фракциями по 1.8 Грей. Увеличивать дозу до 60 Грей пробовали, но на эффективность это не повлияло, а токсичность выросла.
Есть исследования, где предлагаются фракции по 1 Грей два раза в день с общей дозой 60 Грей с целью лучшей переносимости. Коллеги из РНЦРР иногда используют этот режим. Исследования был сделаны в начале 2000-х и не вызывали у меня должного оптимизма для внедрения их в практику из-за небольшого числа участвовавших пациентов и отсутствия явных преимуществ. Мне сложно оценить насколько этот режим может быть оправдан.
Если говорить о подведении больших доз облучения с помощью стереотаксиса, то при DIPG это не актуально вследствие диффузного характера роста и локализации опухоли.
Поэтому при режиме дозирования мы должны находить баланс между нашими возможностями и желаниями, стараться помочь и в тоже время не навредить. И когда мы говорим об опухолях ствола, этот достаточно узкий терапевтический интервал (стандарт 54 Грей), работающий не настолько хорошо, как нам бы хотелось – по сути, единственная опция, которая у нас есть.
8. Необходимость применения дексаметазона/бевацизумаба при проведении ЛТ? Какие плюсы и минусы есть при применении этих подходов?
Все всегда очень индивидуально. ЛТ на стволе можно пройти без дексаметазона, без диуретиков, если опухоль небольших размеров, без отека, без сдавления и т.д.
Бевацизумаб в первой линии лечения обычно не используется. Его применяют позже - через 2-3-4 месяца и далее, когда опухоль начинает отвечать на лучевую терапию, появляются зоны некроза и/или в случае прогрессирования. Бевацизумаб используется, чтобы эти зоны радионекроза остановить и это очень хорошая опция, так как любые структурные изменения в стволе могут приводить клинически значимому изменению в состоянии пациента. Главный плюс дексаметазона в том, что зачастую это вообще единственный препарат, который помогает снизить симптоматику, связанную с DIPG. Минусы – это гормональные нарушения, Синдром Кушинга, последствия в виде гипертонии, эндокринные нарушения, повышение сахара и т.д. Сопроводительная терапия достаточно сложный вопрос и требует высокой квалификации онкологов и слаженной командной работы между онкологом, радиотерапевтом и пациентом.
9.Какая стандартная дозировка дексаметазона во время ЛТ, оптимальный момент начала применения и длительность применения?
Дозировка дексаметазона назначается совместно с онкологами и оптимально должна составлять 0,1-0,5 мг/кг массы тела в сутки. Получается, что дозы варьируются от 2 до 16 мг/сутки в 2-4 приёма. Возможно временное повышение доз в зависимости от состояния пациента. Оптимального момента не существует – всё индивидуально. Бывают пациенты, которые переносят ЛТ по поводу DIPG без дексаметазона (крайне редко), есть пациенты, кому из-за клиники или превентивно назначаются минимальные дозы в первые недели лучевой терапии с постепенной отменной. Часто бывают ситуации, когда пациент приезжает на лучевую терапию уже на существенных дозах дексаметазона. Длительность приёма так же зависит от клинической ситуации, и варьируется от «отмена через 1-2 недели после старта ЛТ» до применения пожизненно. Чаще всего, дексаметазон отменяется в течение месяца после окончания ЛТ.
10.Какова на текущий момент оптимальная дозировка и режим применения бевацизумаба при ЛТ?
Может я чего-то не знаю, но во время ЛТ бевацизумаб обычно не назначается. Он чаще всего назначается после ЛТ, если возникает явление повреждений от терапии, или опухоль начинает активно распадаться, развивается «центральная» симптоматика. По поводу дозировки – на сегодняшний день этот вопрос активно изучается. Раньше считалось, что 10-15 мг/кг массы тела является оптимальной дозой. Потом появились исследования (в основном у взрослых), что минимальные дозировки 5 мг/кг массы тела 1 раз в 2, либо 3 недели имеют такую же эффективность при меньших побочных эффектах. Но в любом случае, дозы и длительность приёма определяется решением нейроонколога и/или консилиумом с участием радиотерапевта.
11.Опишите ваше отношение к повторной лучевой терапии при рецидиве DIPG?
Я отвечу на этот вопрос как клиницист: повторная ЛТ, безусловно, имеет место быть. Есть работы, которые показали, что повторная ЛТ в дозах до 32-34 Гр (в среднем рекомендуется 20-24 Гр) через 6-8 месяцев после первой ЛТ улучшает состояние пациентов примерно в 70% случаев. По сути, это паллиативное лечение и оно имеет право на жизнь. И, наверное, большинство родителей хотели бы, чтобы такая опция была. Тут важно понимать, что несмотря на это лечение, ухудшение неврологического статуса в будущем неизбежно.
С точки зрения организации здравоохранения – ответить однозначно на этот вопрос очень сложно. В условиях ограниченности ресурсов - обеспечить всех пациентов данным видом лечения не представляется возможным. Единичные центры, кто проводит повторную ЛТ.
Таким образом, у меня, как у радиотерапевта, отношение к повторной ЛТ – двойственное, тяжелое. С одной стороны – всегда хочется помогать до конца, а с другой – помогая до конца, мы можем продлить тяжелое состояние пациента, а, возможно, даже сделать хуже, при этом мы понимаем, что шанса на излечение нет. Эта двойственность как раз и представляет главную сложность при принятии решения о повторной ЛТ.
12.Какой на текущий момент можно применять алгоритм для определения оптимального режима дозирования повторной лучевой терапии при рецидиве DIPG?
Не существует протокола или стандарта проведения повторной лучевой терапии при рецидиве DIPG. Есть работы, которые делают выводы о предпочтительных дозах, оставляя окончательное принятие решение радиотерапевту. Необходимо оценивать сроки после первой ЛТ, объем рецидива, структура по МРТ, соматический статус.
13.Какие преимущества и недостатки у прохождения ЛТ (повторной ЛТ) в стационаре и амбулаторно?
Если ребенок может, конечно, в идеале надо проходить лечение в дневном стационаре: нет госпитализма (негативное физическое и психическое состояние, возникающее у человека (особенно у детей) при длительном пребывании в стационаре в отрыве от привычной среды, близких людей и при недостатке эмоциональных стимулов), нет госпитальных инфекций, пациент находится в комфортных условиях дома, или в гостинице с родными и близкими людьми и т.д. Но у пациентов с DIPG чаще всего уже есть неврологические нарушения, либо риск этих нарушений крайне высок. И если смотреть с этой стороны, то лучше проходить ЛТ в круглосуточном стационаре. У нас было много пациентов, у которых все хорошо, а потом в два часа ночи возникают судороги. Наличие реанимации и постоянное дежурство врачей позволяет купировать эти тяжелые состояния. Через 2-3 дня после нормализации состояния зачастую можно продолжать лечение. Поэтому преимущество круглосуточного стационара – это постоянный присмотр, но сопряженный с госпитализмом и общим дискомфортом. Дневной стационар – это достаточно комфортная среда, детям там проще психологически. По возможности, конечно, надо лечиться амбулаторно – через дневной стационар.
14.Должен ли рассматриваться вариант протонной терапии вместо фотонной при DIPG? Если да, то в каких случаях?
Эффективность протонной терапии полностью аналогична эффективности фотонной. К сожалению, многие думают, что протоны – это какая-то «палочка-выручалочка», которая может излечить. Не просто так в 17-18 годах были опубликованы исследования, которые показали, что 90% информации, опубликованной на сайтах центров протонной терапии в США, является ложной и вводит пациентов в заблуждение. Это делалось с целью, чтобы пациенты приезжали именно в их центры для прохождения лечения – т.е. это исключительно маркетинговая история. У протонной терапии есть преимущества по сравнению с фотонной в определённых клинических ситуациях. Если мы говорим про DIPG – то у протонов таже самая эффективность, что у фотонов. Не лучше. Выигрыш от снижения поздней токсичности по сравнению с фотонами так же является недостоверным аргументом, когда мы говорим о пациентах с DIPG. Пациенты просто не успеют ее реализовать во первых. А во-вторых, качественно выполненная фотонная ЛТ будет абсолютно идентичной по осложнениям в сравнении с протонами. Так же все рекомендации, которые существуют в мире (Английские, японские, американские) не рекомендуют проведение протонной терапии пациентам с high-grade глиомами, при диффузных глиомах ствола. Возможно, в будущем, когда мы будем лучше понимать природу, когда появятся лекарственные опции терапии, данный взгляд профессионального сообщества может измениться.
1.Какое оптимальное время для начала лучевой терапии (ЛТ) после постановки диагноза DIPG по результатам МРТ?
Оптимальное время – чем быстрее, тем лучше. Пока нет симптоматики, пока есть нормальный соматический статус пациента нужно начинать лучевую терапию. Это обусловлено тем, что во время проведения ЛТ происходят определенные процессы, которые могут незначительно ухудшать соматический статус пациента на какой-то период. И логичнее использовать естественный компенсаторный резерв организма на возможные осложнения при ЛТ, чем на прогрессию заболевания с течением времени ожидания. Но вопрос о лучевой терапии безусловно должен решаться после консультации нейрохирурга и определения возможности выполнения биопсии и/или необходимости выполнения шунтирования.
2.Какое оптимальное время для начала лучевой терапии после операции при DIPG (стереотаксическая биопсия, открытая частичная резекция)?
Здесь все зависит от состояния пациента. В целом, если мы говорим об опыте операций на центральной-нервной системе, то возможно проведение ЛТ – через 2-4 недели после хирургического вмешательства, если оно было. Подготовку к ЛТ (например, КТ-топометрию) можно начинать заранее. Часто КТ-топометрию мы выполняем через 7-10 дней после операции. В обычном режиме ещё одна неделя уходила на расчеты программы ЛТ. За это время пациент полностью восстанавливался после операции и становится готовым к проведению ЛТ. Так же важно помнить, что в онкологии каждый пациент уникален, поэтому могут быть вариации.
3. Сколько времени в среднем требуется для начала ЛТ - от первой консультации у радиотерапевта до первой фракции ЛТ?
Этапы подготовки к ЛТ включают в себя: Консультацию; КТ-топометрию с изготовлением индивидуальных фиксирующих приспособлений; оконтуривание - на этом этапе подгружаются МРТ, ПЭТ-КТ (если есть); расчет программы лечения медицинскими физиками; проверка программы лечения (гарантия качества); старт лечения. В нормальном, рабочем режиме эти этапы занимают в среднем 3-5 рабочих дней. Это когда все делается спокойно, правильно и без спешки. Но бывают ситуации, когда пациенты поступают в тяжёлом соматическом статусе, с отрицательной динамикой и требуется срочное начало ЛТ. В таких случаях все силы бросаются на ускорение процессов подготовки и ЛТ может начинаться на следующий день, или даже день-в-день. Это не очень хорошая практика, которая не должна идти на потоке ввиду многих сложных аспектов проведения ЛТ, но при острой необходимости, такая возможность есть.
4. Какие исследования обязательны для выполнения (например, КТ, МРТ) перед процедурой расчетов и разметки? Какие рекомендуются дополнительно (ПЭТ-КТ?)
КТ-топометрия с фиксацией выполняется исключительно на базе учреждения, где пациент будет проходить ЛТ для того, что бы кривая КТ была внесена в планируюущую станцию для верности расчёта. Изготавливается специальная маска для фиксации головы. Специальной подготовки со стороны пациента не нужно, кроме тех случаев, когда у пациента много волос – их необходимо коротко постричь. Если пациенту проводилась операция, то требуется МРТ до операции и перед началом ЛТ. У нас в отделении правило, что МРТ-исследование при опухоли ЦНС не должно быть старше 3-4 недель до момента начала ЛТ. Некоторым пациентам мы делаем МРТ-топометрию на этапе подготовки к ЛТ, но большинству пациентов подгружаем обычное диагностическое МРТ, поэтому, чем ближе началу ЛТ оно выполнено, тем лучше. В идеале – 1-2 недели. Наши онкологи это знают, поэтому планируют МРТ таким образом, чтобы на следующий день после МРТ мы уже делаем КТ-топометрию. По поводу необходимости выполнения ПЭТ-КТ: есть опухоли ЦНС, для которых это делать нужно, но при DIPG это не актуально, так как это исследование не несет большой смысловой нагрузки при планировании и не будет влиять на подход к проведению ЛТ. Соответственно нет необходимости тратить на ПЭТ-КТ время. При DIPG в 99.9% случаях МРТ полностью отвечает нам, где опухоль распространяется.
5. Влияет ли молекулярно-генетический, или гистологический профиль опухоли на тактику проведения ЛТ, на сопроводительную терапию?
На сегодняшний день, увы, никак не влияет. Неважно на чём, когда и где вы облучаетесь – для ствола головного мозга стандарт будет 54 Грей в связи с ограничениями, которые накладывает данная локализация опухоли. Сопроводительная терапия обусловлена острыми реакциями на ЛТ – отечность, воспаление и т.д., Значит, при необходимости, будет проводится противоотечная терапия – тот же дексаметазон, либо диуретики. Так же будет влиять и статус пациента – от этого зависит интенсивность сопроводительной терапии.
6. Используются ли сегодня в России радиосенсибилизаторы при наличии образца опухоли?
Сейчас идут исследования, где используются различные препараты в качестве радиосенсибилизаторов при high-grade глиомах и диффузных опухолях ствола, но к сожалению, я не видел положительных результатов при DIPG (на осень 2024 года). На сегодняшний день стандартом является проведение лучевой терапии в монорежиме.
7. Какой на текущий момент оптимальный режим дозирования лучевой терапии в первой линии лечения DIPG?
При DIPG оптимальный стандартный режим - 54 Грей с фракциями по 1.8 Грей. Увеличивать дозу до 60 Грей пробовали, но на эффективность это не повлияло, а токсичность выросла.
Есть исследования, где предлагаются фракции по 1 Грей два раза в день с общей дозой 60 Грей с целью лучшей переносимости. Коллеги из РНЦРР иногда используют этот режим. Исследования был сделаны в начале 2000-х и не вызывали у меня должного оптимизма для внедрения их в практику из-за небольшого числа участвовавших пациентов и отсутствия явных преимуществ. Мне сложно оценить насколько этот режим может быть оправдан.
Если говорить о подведении больших доз облучения с помощью стереотаксиса, то при DIPG это не актуально вследствие диффузного характера роста и локализации опухоли.
Поэтому при режиме дозирования мы должны находить баланс между нашими возможностями и желаниями, стараться помочь и в тоже время не навредить. И когда мы говорим об опухолях ствола, этот достаточно узкий терапевтический интервал (стандарт 54 Грей), работающий не настолько хорошо, как нам бы хотелось – по сути, единственная опция, которая у нас есть.
8. Необходимость применения дексаметазона/бевацизумаба при проведении ЛТ? Какие плюсы и минусы есть при применении этих подходов?
Все всегда очень индивидуально. ЛТ на стволе можно пройти без дексаметазона, без диуретиков, если опухоль небольших размеров, без отека, без сдавления и т.д.
Бевацизумаб в первой линии лечения обычно не используется. Его применяют позже - через 2-3-4 месяца и далее, когда опухоль начинает отвечать на лучевую терапию, появляются зоны некроза и/или в случае прогрессирования. Бевацизумаб используется, чтобы эти зоны радионекроза остановить и это очень хорошая опция, так как любые структурные изменения в стволе могут приводить клинически значимому изменению в состоянии пациента. Главный плюс дексаметазона в том, что зачастую это вообще единственный препарат, который помогает снизить симптоматику, связанную с DIPG. Минусы – это гормональные нарушения, Синдром Кушинга, последствия в виде гипертонии, эндокринные нарушения, повышение сахара и т.д. Сопроводительная терапия достаточно сложный вопрос и требует высокой квалификации онкологов и слаженной командной работы между онкологом, радиотерапевтом и пациентом.
9.Какая стандартная дозировка дексаметазона во время ЛТ, оптимальный момент начала применения и длительность применения?
Дозировка дексаметазона назначается совместно с онкологами и оптимально должна составлять 0,1-0,5 мг/кг массы тела в сутки. Получается, что дозы варьируются от 2 до 16 мг/сутки в 2-4 приёма. Возможно временное повышение доз в зависимости от состояния пациента. Оптимального момента не существует – всё индивидуально. Бывают пациенты, которые переносят ЛТ по поводу DIPG без дексаметазона (крайне редко), есть пациенты, кому из-за клиники или превентивно назначаются минимальные дозы в первые недели лучевой терапии с постепенной отменной. Часто бывают ситуации, когда пациент приезжает на лучевую терапию уже на существенных дозах дексаметазона. Длительность приёма так же зависит от клинической ситуации, и варьируется от «отмена через 1-2 недели после старта ЛТ» до применения пожизненно. Чаще всего, дексаметазон отменяется в течение месяца после окончания ЛТ.
10.Какова на текущий момент оптимальная дозировка и режим применения бевацизумаба при ЛТ?
Может я чего-то не знаю, но во время ЛТ бевацизумаб обычно не назначается. Он чаще всего назначается после ЛТ, если возникает явление повреждений от терапии, или опухоль начинает активно распадаться, развивается «центральная» симптоматика. По поводу дозировки – на сегодняшний день этот вопрос активно изучается. Раньше считалось, что 10-15 мг/кг массы тела является оптимальной дозой. Потом появились исследования (в основном у взрослых), что минимальные дозировки 5 мг/кг массы тела 1 раз в 2, либо 3 недели имеют такую же эффективность при меньших побочных эффектах. Но в любом случае, дозы и длительность приёма определяется решением нейроонколога и/или консилиумом с участием радиотерапевта.
11.Опишите ваше отношение к повторной лучевой терапии при рецидиве DIPG?
Я отвечу на этот вопрос как клиницист: повторная ЛТ, безусловно, имеет место быть. Есть работы, которые показали, что повторная ЛТ в дозах до 32-34 Гр (в среднем рекомендуется 20-24 Гр) через 6-8 месяцев после первой ЛТ улучшает состояние пациентов примерно в 70% случаев. По сути, это паллиативное лечение и оно имеет право на жизнь. И, наверное, большинство родителей хотели бы, чтобы такая опция была. Тут важно понимать, что несмотря на это лечение, ухудшение неврологического статуса в будущем неизбежно.
С точки зрения организации здравоохранения – ответить однозначно на этот вопрос очень сложно. В условиях ограниченности ресурсов - обеспечить всех пациентов данным видом лечения не представляется возможным. Единичные центры, кто проводит повторную ЛТ.
Таким образом, у меня, как у радиотерапевта, отношение к повторной ЛТ – двойственное, тяжелое. С одной стороны – всегда хочется помогать до конца, а с другой – помогая до конца, мы можем продлить тяжелое состояние пациента, а, возможно, даже сделать хуже, при этом мы понимаем, что шанса на излечение нет. Эта двойственность как раз и представляет главную сложность при принятии решения о повторной ЛТ.
12.Какой на текущий момент можно применять алгоритм для определения оптимального режима дозирования повторной лучевой терапии при рецидиве DIPG?
Не существует протокола или стандарта проведения повторной лучевой терапии при рецидиве DIPG. Есть работы, которые делают выводы о предпочтительных дозах, оставляя окончательное принятие решение радиотерапевту. Необходимо оценивать сроки после первой ЛТ, объем рецидива, структура по МРТ, соматический статус.
13.Какие преимущества и недостатки у прохождения ЛТ (повторной ЛТ) в стационаре и амбулаторно?
Если ребенок может, конечно, в идеале надо проходить лечение в дневном стационаре: нет госпитализма (негативное физическое и психическое состояние, возникающее у человека (особенно у детей) при длительном пребывании в стационаре в отрыве от привычной среды, близких людей и при недостатке эмоциональных стимулов), нет госпитальных инфекций, пациент находится в комфортных условиях дома, или в гостинице с родными и близкими людьми и т.д. Но у пациентов с DIPG чаще всего уже есть неврологические нарушения, либо риск этих нарушений крайне высок. И если смотреть с этой стороны, то лучше проходить ЛТ в круглосуточном стационаре. У нас было много пациентов, у которых все хорошо, а потом в два часа ночи возникают судороги. Наличие реанимации и постоянное дежурство врачей позволяет купировать эти тяжелые состояния. Через 2-3 дня после нормализации состояния зачастую можно продолжать лечение. Поэтому преимущество круглосуточного стационара – это постоянный присмотр, но сопряженный с госпитализмом и общим дискомфортом. Дневной стационар – это достаточно комфортная среда, детям там проще психологически. По возможности, конечно, надо лечиться амбулаторно – через дневной стационар.
14.Должен ли рассматриваться вариант протонной терапии вместо фотонной при DIPG? Если да, то в каких случаях?
Эффективность протонной терапии полностью аналогична эффективности фотонной. К сожалению, многие думают, что протоны – это какая-то «палочка-выручалочка», которая может излечить. Не просто так в 17-18 годах были опубликованы исследования, которые показали, что 90% информации, опубликованной на сайтах центров протонной терапии в США, является ложной и вводит пациентов в заблуждение. Это делалось с целью, чтобы пациенты приезжали именно в их центры для прохождения лечения – т.е. это исключительно маркетинговая история. У протонной терапии есть преимущества по сравнению с фотонной в определённых клинических ситуациях. Если мы говорим про DIPG – то у протонов таже самая эффективность, что у фотонов. Не лучше. Выигрыш от снижения поздней токсичности по сравнению с фотонами так же является недостоверным аргументом, когда мы говорим о пациентах с DIPG. Пациенты просто не успеют ее реализовать во первых. А во-вторых, качественно выполненная фотонная ЛТ будет абсолютно идентичной по осложнениям в сравнении с протонами. Так же все рекомендации, которые существуют в мире (Английские, японские, американские) не рекомендуют проведение протонной терапии пациентам с high-grade глиомами, при диффузных глиомах ствола. Возможно, в будущем, когда мы будем лучше понимать природу, когда появятся лекарственные опции терапии, данный взгляд профессионального сообщества может измениться.
03
ХИМИОТЕРАПИЯ
Химиотерапия и DIPG
За последние несколько десятилетий показатели излечения детей от рака значительно улучшились: с менее чем 50 % в 1960-х годах до почти 80 % сегодня. Это удивительная история лабораторных исследований, которые позволили лучше понять, как протекает детский рак. Это история беспрецедентного сотрудничества между сотнями детских онкологических центров по всей стране и миру. Это история детских онкологов, радиационных онкологов и хирургов, работающих вместе, чтобы улучшить жизнь детей, больных раком. Это история о силе, душевной боли, стойкости, вдохновении и защите детей, больных раком, и их семей, которые как никто другой способствовали продвижению этой области медицины вперед.
Однако успехи в лечении детей, больных раком, были неодинаковыми. В лечении некоторых видов детского рака были достигнуты значительные успехи, но показатели излечения других остаются на прежнем уровне. Именно так обстоит дело с детьми с глиомой ствола мозга, для которых успех, к сожалению, не осязаем и не ощутим. Хирургическое удаление этой опухоли невозможно (но не всегда). Более того, у таких детей редко берут биопсию (сейчас намного чаще, чем раньше), поэтому образцы опухоли недоступны, чтобы помочь исследователям понять эту болезнь. Лучевая терапия оказалось достаточно эффективной, но лишь на короткое время. Остаются химиотерапия и биопрепараты. Казалось бы, для опухоли, которую нельзя удалить хирургическим путем и которая лишь временно реагирует на лучевую терапию, химиотерапия может быть лучшим подходом к этому сложному заболеванию. Но это оказалось не так. Несмотря на десятилетия исследований и клинических испытаний, ученые до сих пор не нашли химиотерапевтического или биологического препарата, который бы улучшил выживаемость детей с глиомой ствола мозга. Но это не значит, что таких препаратов никогда не найдут. На самом деле, возможно, именно новый препарат или какая-то таргетная терапия, основанная на лучшем понимании биологии глиомы ствола мозга, приведет к будущему успеху в лечении детей с этим заболеванием. Этот день еще не наступил, но он обязательно наступит. Здесь рассматривается, что такое химиотерапия, почему она не помогла детям с глиомой ствола мозга, что было испробовано и что обещает успех. Также рассматриваются биологические методы лечения (т. е. лечение, направленное на некоторые механизмы, которые опухолевые клетки используют для роста).
Химиотерапия - это просто любое лекарство, которое убивает раковые клетки. Как «антибиотик» относится к широкому классу лекарств, используемых для лечения инфекций, так и химиотерапия относится к широкому классу лекарств, используемых для лечения рака. Химиотерапию можно вводить внутривенно, через инъекцию в кожу или мышцу, перорально или даже непосредственно в полость тела (например, введение химиопрепарата в спинномозговую жидкость при спинномозговой пункции; также возможна установка Резервуара Оммайя для введения препаратов непосредственно в ликвор). В большинстве случаев химиотерапию вводят внутривенно или перорально. Химиотерапия действует на клетки, которые активно делятся, тем самым останавливая размножение раковых клеток. Существует множество различных типов химиотерапевтических препаратов, и каждый из них направлен на один из множества различных аспектов деления опухолевых клеток.
Для многих детских онкологических заболеваний было показано, что при использовании комбинированной химиотерапии - двух, трех или более препаратов вместе - выживаемость ребенка повышается. Это происходит потому, что несколько препаратов вместе лучше убивают раковые клетки, чем один препарат в отдельности. Кроме того, если опухоль устойчива к одному препарату, она может быть убита одним из других.
Недостатком химиотерапии (особенно при лечении детей с опухолями мозга) является то, что она циркулирует в организме ребенка повсюду, а значит, может убить или повредить нормально делящиеся клетки. Этим фактом объясняются многие побочные эффекты химиотерапии, такие как низкие показатели крови, риск инфекции, кровотечения, усталость, язвы во рту, тошнота и рвота.
Трудности применения химиотерапии для детей с глиомой ствола мозга
Поиск эффективной химиотерапии для детей с опухолями мозга более сложен, чем поиск эффективной химиотерапии для детей с другими злокачественными опухолями. Основной проблемой при опухолях головного мозга является наличие гематоэнцефалического барьера. Кровеносные сосуды в мозге уникальны: они устроены таким образом, что очень избирательно относятся к тому, что может проникнуть в них, чтобы попасть в клетки мозга. Они избирательно пропускают питательные вещества к клеткам мозга, но блокируют многие нераспознанные, потенциально токсичные вещества, включая многие виды химиотерапии. С точки зрения эволюции это вполне логично (т. е. защита мозга от токсинов), но когда дело доходит до попадания химиотерапии в опухоли мозга, это становится проблемой. Поэтому химиотерапия должна быть разработана таким образом, чтобы проникать через гематоэнцефалический барьер. Список препаратов, которые могут это сделать, невелик, поэтому у нас остается все меньше вариантов, которые можно использовать для лечения детей с опухолями мозга. Считается (но не доказано), что кровеносные сосуды в глиомах ствола мозга особенно ограничены и позволяют проникать в них очень немногим веществам.
Недавнее исследование доктора Адама Грина показало, что традиционная химиотерапия может достигать тканей DIPG с достаточной концентрацией, чтобы быть эффективной..
Еще одной проблемой является сама опухоль. По неясным (и до сих пор точно не доказанным) причинам оказывается, что опухолевые клетки, из которых состоят глиомы ствола мозга, чрезвычайно устойчивы к химиотерапии. То есть, даже если химиотерапия попадает в опухоль, она не может убить опухолевые клетки..
Оригинал статьи здесь.
Однако успехи в лечении детей, больных раком, были неодинаковыми. В лечении некоторых видов детского рака были достигнуты значительные успехи, но показатели излечения других остаются на прежнем уровне. Именно так обстоит дело с детьми с глиомой ствола мозга, для которых успех, к сожалению, не осязаем и не ощутим. Хирургическое удаление этой опухоли невозможно (но не всегда). Более того, у таких детей редко берут биопсию (сейчас намного чаще, чем раньше), поэтому образцы опухоли недоступны, чтобы помочь исследователям понять эту болезнь. Лучевая терапия оказалось достаточно эффективной, но лишь на короткое время. Остаются химиотерапия и биопрепараты. Казалось бы, для опухоли, которую нельзя удалить хирургическим путем и которая лишь временно реагирует на лучевую терапию, химиотерапия может быть лучшим подходом к этому сложному заболеванию. Но это оказалось не так. Несмотря на десятилетия исследований и клинических испытаний, ученые до сих пор не нашли химиотерапевтического или биологического препарата, который бы улучшил выживаемость детей с глиомой ствола мозга. Но это не значит, что таких препаратов никогда не найдут. На самом деле, возможно, именно новый препарат или какая-то таргетная терапия, основанная на лучшем понимании биологии глиомы ствола мозга, приведет к будущему успеху в лечении детей с этим заболеванием. Этот день еще не наступил, но он обязательно наступит. Здесь рассматривается, что такое химиотерапия, почему она не помогла детям с глиомой ствола мозга, что было испробовано и что обещает успех. Также рассматриваются биологические методы лечения (т. е. лечение, направленное на некоторые механизмы, которые опухолевые клетки используют для роста).
Химиотерапия - это просто любое лекарство, которое убивает раковые клетки. Как «антибиотик» относится к широкому классу лекарств, используемых для лечения инфекций, так и химиотерапия относится к широкому классу лекарств, используемых для лечения рака. Химиотерапию можно вводить внутривенно, через инъекцию в кожу или мышцу, перорально или даже непосредственно в полость тела (например, введение химиопрепарата в спинномозговую жидкость при спинномозговой пункции; также возможна установка Резервуара Оммайя для введения препаратов непосредственно в ликвор). В большинстве случаев химиотерапию вводят внутривенно или перорально. Химиотерапия действует на клетки, которые активно делятся, тем самым останавливая размножение раковых клеток. Существует множество различных типов химиотерапевтических препаратов, и каждый из них направлен на один из множества различных аспектов деления опухолевых клеток.
Для многих детских онкологических заболеваний было показано, что при использовании комбинированной химиотерапии - двух, трех или более препаратов вместе - выживаемость ребенка повышается. Это происходит потому, что несколько препаратов вместе лучше убивают раковые клетки, чем один препарат в отдельности. Кроме того, если опухоль устойчива к одному препарату, она может быть убита одним из других.
Недостатком химиотерапии (особенно при лечении детей с опухолями мозга) является то, что она циркулирует в организме ребенка повсюду, а значит, может убить или повредить нормально делящиеся клетки. Этим фактом объясняются многие побочные эффекты химиотерапии, такие как низкие показатели крови, риск инфекции, кровотечения, усталость, язвы во рту, тошнота и рвота.
Трудности применения химиотерапии для детей с глиомой ствола мозга
Поиск эффективной химиотерапии для детей с опухолями мозга более сложен, чем поиск эффективной химиотерапии для детей с другими злокачественными опухолями. Основной проблемой при опухолях головного мозга является наличие гематоэнцефалического барьера. Кровеносные сосуды в мозге уникальны: они устроены таким образом, что очень избирательно относятся к тому, что может проникнуть в них, чтобы попасть в клетки мозга. Они избирательно пропускают питательные вещества к клеткам мозга, но блокируют многие нераспознанные, потенциально токсичные вещества, включая многие виды химиотерапии. С точки зрения эволюции это вполне логично (т. е. защита мозга от токсинов), но когда дело доходит до попадания химиотерапии в опухоли мозга, это становится проблемой. Поэтому химиотерапия должна быть разработана таким образом, чтобы проникать через гематоэнцефалический барьер. Список препаратов, которые могут это сделать, невелик, поэтому у нас остается все меньше вариантов, которые можно использовать для лечения детей с опухолями мозга. Считается (но не доказано), что кровеносные сосуды в глиомах ствола мозга особенно ограничены и позволяют проникать в них очень немногим веществам.
Недавнее исследование доктора Адама Грина показало, что традиционная химиотерапия может достигать тканей DIPG с достаточной концентрацией, чтобы быть эффективной..
Еще одной проблемой является сама опухоль. По неясным (и до сих пор точно не доказанным) причинам оказывается, что опухолевые клетки, из которых состоят глиомы ствола мозга, чрезвычайно устойчивы к химиотерапии. То есть, даже если химиотерапия попадает в опухоль, она не может убить опухолевые клетки..
Оригинал статьи здесь.
04
РАДИО-
СЕНСИБИЛИЗАТОРЫ
СЕНСИБИЛИЗАТОРЫ
Радиосенсибилизаторы и DIPG
Лучевая терапия остается единственным эффективным методом лечения глиомы ствола мозга у детей. Поскольку ее эффективность для большинства пациентов является временной, попытки повысить эффективность лучевой терапии находятся в центре внимания клинических исследований. Эти попытки включали в себя увеличение общей дозы проводимой лучевой терапии и изменение фракционирования получаемого излучения (т. е. времени облучения в день и дозы при каждом облучении). На сегодняшний день эти изменения не привели к улучшению выживаемости. Использование нескольких небольших доз облучения в день для получения большей общей суточной дозы (так называемая гиперфракционированная лучевая терапия) привело к повышению токсичности. Лучевое повреждение ствола мозга (так называемый лучевой некроз/радионекроз) приводит к усилению неврологического дефицита.
Радиосенсибилизаторы
Радиосенсибилизация - еще один способ улучшить терапевтический баланс между эффективностью и токсичностью лучевой терапии. Эти исследования проводились в течение последних двух десятилетий и продолжают изучаться. Радиосенсибилизаторы - это вещества (соединения), которые в сочетании с лучевой терапией достигают большей деактивации опухоли, чем можно было бы ожидать от суммарного эффекта двух методов лечения. В основе радиосенсибилизации лежит предположение о том, что токсичности используемого химического агента и излучения не должны значительно пересекаться (перекрываться), тем самым общая токсичность не увеличивается. Кроме того, выбранный химический агент не должен делать лучевую терапию более токсичной для нормальных клеток мозга в той области мозга, которая подвергается облучению. В оптимальном варианте преимущества радиосенсибилизации должны позволить облучать опухолевый участок более высокой дозой радиации без увеличения токсичности. В реальности этот ожидаемый синергетический эффект радиосенсибилизации представляет собой баланс между тем, насколько эффективнее радиосенсибилизаторы уничтожают больше опухолевых клеток, и тем, насколько более разрушительным будет лечение для нормальных клеток, подвергшихся радиотерапии.
Другая основная концепция, которую было трудно доказать на примере глиомы ствола мозга, заключается в том, что увеличение эффективной дозы лучевой терапии действительно улучшает контроль над заболеванием. В лучшем случае большинство радиосенсибилизаторов увеличивают интенсивность дозы лучевой терапии на 20-30 %, однако неясно, приводит ли такое увеличение к улучшению долгосрочного контроля над заболеванием.
Типы радиосенсибилизаторов
Сенсибилизаторы гипоксических клеток
Наиболее крупный ранний опыт применения радиосенсибилизаторов был связан с использованием агентов, которые действуют для сенсибилизации гипоксических клеток к лучевой терапии. Использование этих агентов было основано на предположении, что в глиомах ствола мозга возникает хроническое состояние опухолевой гипоксии (когда опухолевые клетки существуют в среде с низким содержанием кислорода). Использование агентов, которые делают эти гипоксические опухолевые клетки более чувствительными к лучевой терапии, может обеспечить терапевтическое преимущество за счет уничтожения большего количества гипоксических клеток и избавления более насыщенных кислородом клеток (теоретически, нормальных клеток) от повреждающего действия радиации. Ряд сенсибилизаторов гипоксических клеток был использован для лечения других видов рака, но они не применялись при глиомах ствола мозга из-за опасений по поводу токсичности, включая повышенную неврологическую токсичность, и отсутствия явных преимуществ при использовании на других типах опухолей.
Альтернативный способ радиосенсибилизации гипоксических клеток заключается в том, чтобы сделать опухоль менее гипоксичной - другими словами, доставить к клеткам больше кислорода. Для этого используются различные методы: гипербарический кислород, переливание эритроцитов и доставка веществ, переносящих кислород.
Радиосенсибилизация с помощью молекулярно-направленных препаратов и других «биологических агентов»
За последнее десятилетие появилось множество биологических препаратов, которые были испытаны на детях с опухолями мозга. К молекулярно-направленным препаратам относятся:
Выводы
Радиосенсибилизация остается потенциально-интересным подходом к лечению детей с недавно диагностированными глиомами ствола мозга. Как уже говорилось, несмотря на теоретические преимущества, на сегодняшний день существует мало доказательств, подтверждающих повышенную эффективность. Продолжается работа со стандартными химиотерапевтическими препаратами, гипоксическими и негипоксическими радиосенсибилизаторами, а также биологическими агентами. Пока не станет известно больше о базовой биологии глиомы ствола мозга, большинство исследований будут оставаться эмпирическими. Доставка агентов в ствол мозга остается чрезвычайно важным и потенциально ограничивающим фактором. Кроме того, по мере разработки более совершенных агентов критической проблемой будет оставаться их избирательная способность убивать опухолевые клетки и относительно щадить нормальные клетки окружающего мозга.
Оригинал статьи здесь.
Радиосенсибилизаторы
Радиосенсибилизация - еще один способ улучшить терапевтический баланс между эффективностью и токсичностью лучевой терапии. Эти исследования проводились в течение последних двух десятилетий и продолжают изучаться. Радиосенсибилизаторы - это вещества (соединения), которые в сочетании с лучевой терапией достигают большей деактивации опухоли, чем можно было бы ожидать от суммарного эффекта двух методов лечения. В основе радиосенсибилизации лежит предположение о том, что токсичности используемого химического агента и излучения не должны значительно пересекаться (перекрываться), тем самым общая токсичность не увеличивается. Кроме того, выбранный химический агент не должен делать лучевую терапию более токсичной для нормальных клеток мозга в той области мозга, которая подвергается облучению. В оптимальном варианте преимущества радиосенсибилизации должны позволить облучать опухолевый участок более высокой дозой радиации без увеличения токсичности. В реальности этот ожидаемый синергетический эффект радиосенсибилизации представляет собой баланс между тем, насколько эффективнее радиосенсибилизаторы уничтожают больше опухолевых клеток, и тем, насколько более разрушительным будет лечение для нормальных клеток, подвергшихся радиотерапии.
Другая основная концепция, которую было трудно доказать на примере глиомы ствола мозга, заключается в том, что увеличение эффективной дозы лучевой терапии действительно улучшает контроль над заболеванием. В лучшем случае большинство радиосенсибилизаторов увеличивают интенсивность дозы лучевой терапии на 20-30 %, однако неясно, приводит ли такое увеличение к улучшению долгосрочного контроля над заболеванием.
Типы радиосенсибилизаторов
Сенсибилизаторы гипоксических клеток
Наиболее крупный ранний опыт применения радиосенсибилизаторов был связан с использованием агентов, которые действуют для сенсибилизации гипоксических клеток к лучевой терапии. Использование этих агентов было основано на предположении, что в глиомах ствола мозга возникает хроническое состояние опухолевой гипоксии (когда опухолевые клетки существуют в среде с низким содержанием кислорода). Использование агентов, которые делают эти гипоксические опухолевые клетки более чувствительными к лучевой терапии, может обеспечить терапевтическое преимущество за счет уничтожения большего количества гипоксических клеток и избавления более насыщенных кислородом клеток (теоретически, нормальных клеток) от повреждающего действия радиации. Ряд сенсибилизаторов гипоксических клеток был использован для лечения других видов рака, но они не применялись при глиомах ствола мозга из-за опасений по поводу токсичности, включая повышенную неврологическую токсичность, и отсутствия явных преимуществ при использовании на других типах опухолей.
Альтернативный способ радиосенсибилизации гипоксических клеток заключается в том, чтобы сделать опухоль менее гипоксичной - другими словами, доставить к клеткам больше кислорода. Для этого используются различные методы: гипербарический кислород, переливание эритроцитов и доставка веществ, переносящих кислород.
Радиосенсибилизация с помощью молекулярно-направленных препаратов и других «биологических агентов»
За последнее десятилетие появилось множество биологических препаратов, которые были испытаны на детях с опухолями мозга. К молекулярно-направленным препаратам относятся:
- Антиангиогенные препараты;
- Препараты, блокирующие рецепторы факторов роста;
- Препараты, которые вмешиваются во внутриклеточную сигнализацию, необходимую для роста опухоли.
Выводы
Радиосенсибилизация остается потенциально-интересным подходом к лечению детей с недавно диагностированными глиомами ствола мозга. Как уже говорилось, несмотря на теоретические преимущества, на сегодняшний день существует мало доказательств, подтверждающих повышенную эффективность. Продолжается работа со стандартными химиотерапевтическими препаратами, гипоксическими и негипоксическими радиосенсибилизаторами, а также биологическими агентами. Пока не станет известно больше о базовой биологии глиомы ствола мозга, большинство исследований будут оставаться эмпирическими. Доставка агентов в ствол мозга остается чрезвычайно важным и потенциально ограничивающим фактором. Кроме того, по мере разработки более совершенных агентов критической проблемой будет оставаться их избирательная способность убивать опухолевые клетки и относительно щадить нормальные клетки окружающего мозга.
Оригинал статьи здесь.
05
ИММУНОТЕРАПИЯ
CAR-T терапия
Химерный рецептор антигена (Chimeric antigen receptor, CAR) - это рекомбинантный гибридный белок, сочетающий фрагмент антитела, обладающий способностью очень избирательно связываться с конкретными антигенами, с сигнализирующими доменами, способными активировать Т-клетки. Поскольку такой гибридный белок состоит из частей, полученных из разных источников, его называют химерным. Иммунные эффекторные клетки, имеющие сконструированные таким образом CAR, приобретают высокую селективность за счёт добавленного извне рецептора от моноклонального антитела
CAR Т-клеточная терапия, направленная на антиген CD19, биомаркер В-клеток, получила одобрение FDA для лечения В-клеточного острого
лимфобластного лейкоза и диффузной крупноклеточной В-лимфомы. Впоследствии CAR T-клеточная терапия была широко изучена для лечения различных солидных опухолей, включая рак молочной железы, глиому, рак печени - с CAR, разработанными для воздействия на CD19, IL13Rα2, EGFRvIII, HER2 и CD70.
В 2018 году Christopher et al. выявили повышенную экспрессию GD2 в DIPG и продемонстрировали многообещающую доклиническую эффективность GD2-направленной CAR T-клеточной терапии. Иммунотерапия, направленная на GD2, была исследована клинически и доклинически у пациентов с нейробластомой, остеосаркомой и меланомой. Несмотря на многообещающую доклиническую эффективность, для успешного внедрения GD2-таргетной CAR T-клеточной терапии в клинику необходимо устранить серьезные побочные эффекты, такие как гидроцефалия, обусловленная перитуморальным воспалением в острой фазе антинеопластической терапии. В клиническом исследовании I фазы терапии GD2 CAR T-клетками на людях (NCT04196413), опубликованном в журнале Nature в 2022 году, сообщалось о первом клиническом исследовании на четырех пациентах с H3K27M-мутированным DMG. Первоначальное лечение включало внутривенное введение GD2 CAR T-клеток, а пациенты, показавшие клинический эффект, прошли последующее внутрижелудочковое (интравентрикулярное) введение GD2 CAR-T-клетками. У трех из четырех пациентов наблюдалось клиническое и рентгенографическое улучшение, что говорит о многообещающей терапевтической перспективе для H3K27M-мутированного DMG.
В заключение следует отметить, что GD2-таргетированная терапия CAR T-клетками доказала свою эффективность при лечении H3K27M-мутированной DIPG. CAR T-клетки точно нацелены на опухолевые клетки, повышая эффективность и снижая токсичность. Тем не менее, управление побочными реакциями остается главной проблемой, требующей тщательного мониторинга и надлежащего решения.
Оригинал статьи здесь.
CAR Т-клеточная терапия, направленная на антиген CD19, биомаркер В-клеток, получила одобрение FDA для лечения В-клеточного острого
лимфобластного лейкоза и диффузной крупноклеточной В-лимфомы. Впоследствии CAR T-клеточная терапия была широко изучена для лечения различных солидных опухолей, включая рак молочной железы, глиому, рак печени - с CAR, разработанными для воздействия на CD19, IL13Rα2, EGFRvIII, HER2 и CD70.
В 2018 году Christopher et al. выявили повышенную экспрессию GD2 в DIPG и продемонстрировали многообещающую доклиническую эффективность GD2-направленной CAR T-клеточной терапии. Иммунотерапия, направленная на GD2, была исследована клинически и доклинически у пациентов с нейробластомой, остеосаркомой и меланомой. Несмотря на многообещающую доклиническую эффективность, для успешного внедрения GD2-таргетной CAR T-клеточной терапии в клинику необходимо устранить серьезные побочные эффекты, такие как гидроцефалия, обусловленная перитуморальным воспалением в острой фазе антинеопластической терапии. В клиническом исследовании I фазы терапии GD2 CAR T-клетками на людях (NCT04196413), опубликованном в журнале Nature в 2022 году, сообщалось о первом клиническом исследовании на четырех пациентах с H3K27M-мутированным DMG. Первоначальное лечение включало внутривенное введение GD2 CAR T-клеток, а пациенты, показавшие клинический эффект, прошли последующее внутрижелудочковое (интравентрикулярное) введение GD2 CAR-T-клетками. У трех из четырех пациентов наблюдалось клиническое и рентгенографическое улучшение, что говорит о многообещающей терапевтической перспективе для H3K27M-мутированного DMG.
В заключение следует отметить, что GD2-таргетированная терапия CAR T-клетками доказала свою эффективность при лечении H3K27M-мутированной DIPG. CAR T-клетки точно нацелены на опухолевые клетки, повышая эффективность и снижая токсичность. Тем не менее, управление побочными реакциями остается главной проблемой, требующей тщательного мониторинга и надлежащего решения.
Оригинал статьи здесь.
Терапия PD-1/PD-L1
Ингибиторы иммунных контрольных точек произвели революцию в лечении различных опухолей, таких как лимфома, рак почки,
меланома и рак легкого, способствуя увеличению медианы выживаемости пациентов с этими злокачественными новообразованиями.
Ингибиторы иммунных контрольных точек, включая белок программируемой клеточной смерти 1 (PD-1), лиганд программируемой смерти 1 (PD-L1) и другие, демонстрируют способность активировать нормальную иммунную систему, тем самым повышая ее силу. Однако микроокружение опухоли при DIPG характеризуется иммуносупрессией (угнетением иммунитета) и нарушением иммунного надзора, что создает значительные трудности для этой формы лечения.
В клиническом исследовании, проведенном в одном из центров, был проведен ретроспективный когортный анализ детей с рецидивирующей DIPG, проходивших повторную лучевую терапию (reRT) при рецидиве, с ингибированием PD-1 или без него. Результаты показали, что общая выживаемость (OS) у пациентов, получавших повторную лучевую терапию в сочетании с ингибитором PD-1 составила 22,9 месяца по сравнению с с 20,4 месяца у тех кто проходил просто повторную ЛТ.
"В исследование был включен 31 пациент (8 пациентов, получавших повторную лучевую терапию с ниволумабом; 4 пациента, получавших только повторную лучевую терапию; 19 пациентов, не получавших повторную терапию). Пациенты, получавшие повторную терапию, имели более продолжительную OS по сравнению с отсутствием повторной терапии (22,9 месяца - повторная терапия с ниволумабом; 20,4 месяца - только повторная терапия; 8,3 месяца - без повторной терапии; p < 0,0001). Пациенты, получавшие повторную терапию с ниволумабом по сравнению только с повторной терапией, имели несколько более длительную общую выживаемость от диагноза и от повторной терапии (22,9 против 20,4 месяца - от постановки диагноза; 6,8 против 6,0 месяца - от повторной терапии). Все пациенты, получавшие повторную терапию с ниволумабом или без него, переносили лечение без острой или последующей токсичности."
Это позволяет предположить, что комбинация повторной терапии и ингибитора PD-1 обеспечивает преимущество в выживании для пациентов с рецидивирующей DIPG. Учитывая ограниченное активное влияние иммунитета на DIPG, использование одних только ингибиторов PD-1/PD-L1 может оказаться не слишком эффективным, а улучшение общей выживаемости может быть ограниченным. Однако комбинирование этих
ингибиторов с другими таргетными терапиями может дать более многообещающие результаты.
Оригинал статьи здесь.
меланома и рак легкого, способствуя увеличению медианы выживаемости пациентов с этими злокачественными новообразованиями.
Ингибиторы иммунных контрольных точек, включая белок программируемой клеточной смерти 1 (PD-1), лиганд программируемой смерти 1 (PD-L1) и другие, демонстрируют способность активировать нормальную иммунную систему, тем самым повышая ее силу. Однако микроокружение опухоли при DIPG характеризуется иммуносупрессией (угнетением иммунитета) и нарушением иммунного надзора, что создает значительные трудности для этой формы лечения.
В клиническом исследовании, проведенном в одном из центров, был проведен ретроспективный когортный анализ детей с рецидивирующей DIPG, проходивших повторную лучевую терапию (reRT) при рецидиве, с ингибированием PD-1 или без него. Результаты показали, что общая выживаемость (OS) у пациентов, получавших повторную лучевую терапию в сочетании с ингибитором PD-1 составила 22,9 месяца по сравнению с с 20,4 месяца у тех кто проходил просто повторную ЛТ.
"В исследование был включен 31 пациент (8 пациентов, получавших повторную лучевую терапию с ниволумабом; 4 пациента, получавших только повторную лучевую терапию; 19 пациентов, не получавших повторную терапию). Пациенты, получавшие повторную терапию, имели более продолжительную OS по сравнению с отсутствием повторной терапии (22,9 месяца - повторная терапия с ниволумабом; 20,4 месяца - только повторная терапия; 8,3 месяца - без повторной терапии; p < 0,0001). Пациенты, получавшие повторную терапию с ниволумабом по сравнению только с повторной терапией, имели несколько более длительную общую выживаемость от диагноза и от повторной терапии (22,9 против 20,4 месяца - от постановки диагноза; 6,8 против 6,0 месяца - от повторной терапии). Все пациенты, получавшие повторную терапию с ниволумабом или без него, переносили лечение без острой или последующей токсичности."
Это позволяет предположить, что комбинация повторной терапии и ингибитора PD-1 обеспечивает преимущество в выживании для пациентов с рецидивирующей DIPG. Учитывая ограниченное активное влияние иммунитета на DIPG, использование одних только ингибиторов PD-1/PD-L1 может оказаться не слишком эффективным, а улучшение общей выживаемости может быть ограниченным. Однако комбинирование этих
ингибиторов с другими таргетными терапиями может дать более многообещающие результаты.
Оригинал статьи здесь.
Терапия онколитическими вирусами
Онколитические вирусы (ОВ) - это класс вирусов, обладающих способностью избирательно инфицировать и уничтожать опухолевые клетки. Они обладают специфической способностью к репликации и могут стимулировать организм к противоопухолевому иммунному ответу. В основном ОВ делятся на две категории: природные штаммы вирусов и генетически модифицированные штаммы вирусов. Терапевтическая цель достигается за счет специфической инфекции вирусом опухолевых клеток и последующего высвобождения вирусного потомства (новая вирусная частица, образовавшаяся в результате цикла репликации существующего вируса в клетке-хозяине), вызывающего лизис (распад, разрушение) опухолевых клеток.
Ранее созданный аденовирус DNX-2401 (Delta-24-RGD) продемонстрировал безопасность и эффективность на мышиной модели ксенотрансплантата DMG (межвидовая трансплантация опухоли), полученной от пациента, и прошел испытания в рамках I фазы клинических исследований (NCT03178032). В последующем клиническом исследовании I фазы среди 11 пациентов, получавших вирусные частицы DNX-2401 с последующей лучевой терапией, трое показали частичный ответ, у восьми наблюдалась стабильная болезнь, а медиана выживаемости составила 17,8 месяца. Аутопсия (посмертная экспертиза) и образцы опухоли из периферической крови выявили значительные изменения в микроокружении опухоли и пуле Т-клеток, что позволяет предположить, что вирусные частицы DNX-2401 обеспечивают обеспечивают заметное увеличение выживаемости при относительной безопасности при лечении DIPG.
Кроме того, в одноцентровом клиническом исследовании II фазы, инициированном японскими исследователями в 2022 году, оценивалась эффективность онколитического герпесвируса G47Δ в лечении остаточной или рецидивирующей глиобластомы (UMIN-CTR Clinical Trial Registry UMIN000015995). После повторяющихся интратуморальных (прямо в опухоль) введений - МРТ выявила рецидивирующий характер увеличения и четкого усиления поражения после каждой дозы. Результаты биопсии показали повышенное количество инфильтрирующих опухоль CD4/CD8 лимфоцитов при неизменно низком количестве клеток Foxp3, что свидетельствует о положительном эффекте и благоприятном профиле безопасности.
Кроме того, вирус простого герпеса 1716 (HSV1716) продемонстрировал противоопухолевую активность против DMG, показав безвредность для
нормальных нервных клеток и уменьшая инвазию (распространение) опухоли в ортотопической (в то же место) мышиной модели DMG. Хотя никаких результатов, связанных с онколитическим вирусом HSV1716 на сегодняшний день не представлено, другой онколитический аденовирус, CRAd.S.pK7, инкапсулированный (в оболочке) в мезенхимальные (клетки соединительной ткани) стволовые клетки, добился прогресса в мышиных моделях путем интратуморального (прямо в опухоль) введения, решая проблемы доставки онколитического вируса в опухоль и повышая эффективность последующей радиотерапии.
Оригинал статьи здесь.
Ранее созданный аденовирус DNX-2401 (Delta-24-RGD) продемонстрировал безопасность и эффективность на мышиной модели ксенотрансплантата DMG (межвидовая трансплантация опухоли), полученной от пациента, и прошел испытания в рамках I фазы клинических исследований (NCT03178032). В последующем клиническом исследовании I фазы среди 11 пациентов, получавших вирусные частицы DNX-2401 с последующей лучевой терапией, трое показали частичный ответ, у восьми наблюдалась стабильная болезнь, а медиана выживаемости составила 17,8 месяца. Аутопсия (посмертная экспертиза) и образцы опухоли из периферической крови выявили значительные изменения в микроокружении опухоли и пуле Т-клеток, что позволяет предположить, что вирусные частицы DNX-2401 обеспечивают обеспечивают заметное увеличение выживаемости при относительной безопасности при лечении DIPG.
Кроме того, в одноцентровом клиническом исследовании II фазы, инициированном японскими исследователями в 2022 году, оценивалась эффективность онколитического герпесвируса G47Δ в лечении остаточной или рецидивирующей глиобластомы (UMIN-CTR Clinical Trial Registry UMIN000015995). После повторяющихся интратуморальных (прямо в опухоль) введений - МРТ выявила рецидивирующий характер увеличения и четкого усиления поражения после каждой дозы. Результаты биопсии показали повышенное количество инфильтрирующих опухоль CD4/CD8 лимфоцитов при неизменно низком количестве клеток Foxp3, что свидетельствует о положительном эффекте и благоприятном профиле безопасности.
Кроме того, вирус простого герпеса 1716 (HSV1716) продемонстрировал противоопухолевую активность против DMG, показав безвредность для
нормальных нервных клеток и уменьшая инвазию (распространение) опухоли в ортотопической (в то же место) мышиной модели DMG. Хотя никаких результатов, связанных с онколитическим вирусом HSV1716 на сегодняшний день не представлено, другой онколитический аденовирус, CRAd.S.pK7, инкапсулированный (в оболочке) в мезенхимальные (клетки соединительной ткани) стволовые клетки, добился прогресса в мышиных моделях путем интратуморального (прямо в опухоль) введения, решая проблемы доставки онколитического вируса в опухоль и повышая эффективность последующей радиотерапии.
Оригинал статьи здесь.
Вакцинотерапия
Противоопухолевые вакцины действуют путем запуска иммунного ответа против опухолей, и они стали предметом обширных исследований в качестве потенциальных методов лечения глиомы. В клиническом исследовании, посвященном оценке безопасности и эффективности опухолевых вакцин, ранее идентифицированная синтетическая пептидная вакцина под названием H3.3K27 M была протестирована на пациентах с диагнозом DIPG или другими DMG, содержащими мутации H3.3K27 M и мутации HLAA*02:01 (NCT029960230). Результаты показали, что специфическая вакцина хорошо переносится, и приводит к значительному увеличению общей выживаемости пациентов.
"В группу А было включено 19 пациентов (средний возраст 11 лет) и 10 пациентов в группу В (средний возраст 13 лет). Нежелательные явления, связанные с лечением, 4-й степени тяжести не наблюдались. Наиболее часто отмечались реакции в месте инъекции. Общая выживаемость (OS) в 12 месяцев составила 40% для пациентов в группе А и 39% для пациентов в группе В. Медиана общей выживаемости составила 16,1 месяца для пациентов с экспансией (увеличением количества) H3.3K27M-реактивных CD8+ Т-клеток по сравнению с 9,8 месяцами для тех у кого экспансии не наблюдалось. Пациенты с DIPG с изначальным уровнем миелоидных клеток-супрессоров ниже среднего имели более длительную общую выживаемость по сравнению с теми у кого уровень изначально был выше среднего. Предварительное введение дексаметазона имело обратную связь с H3.3K27M-реактивностью CD8+ Т-клеточных ответов"
В 2021 году Майкл Платтен и др. сообщили о первых результатах многоцентрового, одногруппового, открытого клинического исследования I фазы
(NCT02454634) с участием пациентов с глиомой. В этом исследовании 33 пациента с диагностированной IDH-мутантной астроцитомой были вакцинированы IDH1-специфической пептидной вакциной (IDH1-vac). Примечательно, что иммунный ответ, вызванный вакциной, развился у 93,3 % пациентов, в результате чего 2-летний показатель без прогрессирования составил 0,82, а 3-летний показатель без смертности - 0,84, при этом серьезных побочных явлений не наблюдалось. Эти многообещающие результаты вселяют уверенность и закладывают основу для будущих испытаний вакцин в области иммунотерапии рака
Оригинал статьи здесь.
"В группу А было включено 19 пациентов (средний возраст 11 лет) и 10 пациентов в группу В (средний возраст 13 лет). Нежелательные явления, связанные с лечением, 4-й степени тяжести не наблюдались. Наиболее часто отмечались реакции в месте инъекции. Общая выживаемость (OS) в 12 месяцев составила 40% для пациентов в группе А и 39% для пациентов в группе В. Медиана общей выживаемости составила 16,1 месяца для пациентов с экспансией (увеличением количества) H3.3K27M-реактивных CD8+ Т-клеток по сравнению с 9,8 месяцами для тех у кого экспансии не наблюдалось. Пациенты с DIPG с изначальным уровнем миелоидных клеток-супрессоров ниже среднего имели более длительную общую выживаемость по сравнению с теми у кого уровень изначально был выше среднего. Предварительное введение дексаметазона имело обратную связь с H3.3K27M-реактивностью CD8+ Т-клеточных ответов"
В 2021 году Майкл Платтен и др. сообщили о первых результатах многоцентрового, одногруппового, открытого клинического исследования I фазы
(NCT02454634) с участием пациентов с глиомой. В этом исследовании 33 пациента с диагностированной IDH-мутантной астроцитомой были вакцинированы IDH1-специфической пептидной вакциной (IDH1-vac). Примечательно, что иммунный ответ, вызванный вакциной, развился у 93,3 % пациентов, в результате чего 2-летний показатель без прогрессирования составил 0,82, а 3-летний показатель без смертности - 0,84, при этом серьезных побочных явлений не наблюдалось. Эти многообещающие результаты вселяют уверенность и закладывают основу для будущих испытаний вакцин в области иммунотерапии рака
Оригинал статьи здесь.
Цитокинотерапия
Цитокины, вырабатываемые иммунной системой, играют важнейшую роль в регулировании иммунных реакций. Опухоли часто используют цитокины в качестве защитных медиаторов для подавления иммунного ответа. Однако иммуномодулирующие эффекты, вызываемые этими цитокинами, также могут быть использованы для запуска иммунного ответа против опухолевых клеток. Среди цитокинов, используемых в терапии рака, выделяются интерлейкины и интерфероны, одобренные Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) для применения в подобных целях.
Ключевым белком-активатором фактора некроза опухоли является лиганд CD40 (CD40L), который играет важнейшую роль в противоопухолевом иммунитете. Специфически связываясь со своими рецепторами CD40 и CD40L, он способствует прямому уничтожению опухолевых клеток, воспалению и другим патологическим реакциям. Использование аденовируса, экспрессирующего лиганд CD40 (AD-CD40L), для лечения гомологичных глиом, имплантированных в ствол мозга иммунокомпетентных мышей, позволило предположить, что появление CD40L, опосредованное вирусом, может быть эффективным при диффузных глиомах средней линии без обязательной токсичности вследствие нейровоспаления.
Кроме того, Джеймс и др. отметили, что PDGFA-индуцированные опухоли значительно улучшили медиану выживаемости и уменьшили инфильтрацию опухолеассоциированными макрофагами (TAM) по сравнению с PDGFB. Дальнейшие исследования показали, что в опухолях, вызванных PDGFB, наблюдалось сильное воспалительное микроокружение, характеризующееся высокой экспрессией хемокина CCL3. Эти данные свидетельствуют о том, что цитокиновые препараты могут стимулировать специфические иммунные реакции, усиливать апоптоз (естественный процесс программируемой гибели клеток, при котором клетки, в том числе опухолевые, самоуничтожаются) опухолевых клеток и подавлять их пролиферацию. Однако для подтверждения этих наблюдений необходимы дальнейшие клинические исследования.
Оригинал статьи здесь.
Ключевым белком-активатором фактора некроза опухоли является лиганд CD40 (CD40L), который играет важнейшую роль в противоопухолевом иммунитете. Специфически связываясь со своими рецепторами CD40 и CD40L, он способствует прямому уничтожению опухолевых клеток, воспалению и другим патологическим реакциям. Использование аденовируса, экспрессирующего лиганд CD40 (AD-CD40L), для лечения гомологичных глиом, имплантированных в ствол мозга иммунокомпетентных мышей, позволило предположить, что появление CD40L, опосредованное вирусом, может быть эффективным при диффузных глиомах средней линии без обязательной токсичности вследствие нейровоспаления.
Кроме того, Джеймс и др. отметили, что PDGFA-индуцированные опухоли значительно улучшили медиану выживаемости и уменьшили инфильтрацию опухолеассоциированными макрофагами (TAM) по сравнению с PDGFB. Дальнейшие исследования показали, что в опухолях, вызванных PDGFB, наблюдалось сильное воспалительное микроокружение, характеризующееся высокой экспрессией хемокина CCL3. Эти данные свидетельствуют о том, что цитокиновые препараты могут стимулировать специфические иммунные реакции, усиливать апоптоз (естественный процесс программируемой гибели клеток, при котором клетки, в том числе опухолевые, самоуничтожаются) опухолевых клеток и подавлять их пролиферацию. Однако для подтверждения этих наблюдений необходимы дальнейшие клинические исследования.
Оригинал статьи здесь.
06
ТАРГЕТНАЯ
ТЕРАПИЯ
ТЕРАПИЯ
ONC201 (Dordaviprone, Imipridone-201)
Его основная структура - имипридон - направлена на митохондриальную функцию (обеспечение клеток энергией) и оказывает свое действие путем антагонизации дофаминового рецептора D2 (DRD2) (блокирует связь между дофамином и рецептором, т.е. как антипсихотическое лекарство) и/или чрезмерной активации литической активности белка ClpP. Примечательно, что он продемонстрировал исключительную эффективность у пациентов с глиомами, несущими специфическую генную мутацию - мутацию гистона H3K27 M [статья]. Эта эффективность была также продемонстрирована у 22-летнего пациента с DMG с мутацией H3K27M [статья].
После лечения первого пациента с диффузной срединной глиомой с мутацией H3K27M препаратом ONC201 (NCT02525692) был начат протокол расширенного набора пациентов. Впоследствии в него были включены 18 пациентов с H3K27M-мутированной диффузной срединной глиомой (DMG), либо диффузной внутренней глиомой моста (DIPG). Исследователи сообщили об "улучшении по МРТ" либо полном ответе на лечение глиомы таламуса и области моста, а также об улучшении неврологической симптоматики [статья]. Клиническое исследование ONC201 фазы 1 в лечении H3K27 M-мутантной DMG (NCT03416530), опубликованное в 2022 году, было направлено на оценку терапевтического эффекта ONC201 путем анализа свободной опухолевой ДНК в серийных образцах люмбальной пункции и образцах плазмы. Исследование показало, что свободная от клеток опухолевая ДНК в плазме и спинномозговой жидкости (СМЖ) может предсказать ответ на лечение ONC201 и прогрессирование заболевания у пациентов с ДМГ [статья].
Кроме того, Изабель Арриллага-Романи и др. провели лечение с помощью ONC201 - 6 взрослых пациентов с рецидивирующими глиобластомами и 20 пациентов с рецидивирующими
глиобластомами, которым не была проведена хирургическая резекция опухоли. Исследование показало, что ONC201 может быть биологически активен у пациентов с рецидивирующей глиобластомой и хорошо переносится. Мультифокальная H3K27M-мутантная глиобластома у взрослого пациента, получавшего ONC201, продемонстрировала значительный рентгенографический ответ [статья]. Потенциально, это дает основания для применения ONC201 в лечении H3K27 M-мутантных диффузных срединных глиом.
Недавнее клиническое исследование продемонстрировало эффективность ONC201 у 71 пациента с DMG с мутацией H3K27 M, что привело к значительному увеличению общей выживаемости (overall survival, OS). Медиана общей выживаемости (median OS) пациентов, получавших лечение ONC201 в первой линии, составила 21,7 месяца, что на 9,7 месяца выше исторических показателей. Кроме того, почти треть пациентов прожила более 2 лет [статья].
Для повышения эффективности и безопасности лечения диффузных срединных глиом было создано второе поколение имидазольных препаратов, включая ONC206 и ONC212. И ONC201, и ONC206 могут напрямую связываться с белком ClpP. В исследовании 2022 года сравнивалась относительная эффективность ONC201 и ONC206, и было показано, что оба препарата снижают жизнеспособность клеток DMG и увеличивают время выживания PDX-моделей (клетки свежей ткани опухоли трансплантируются мыши) диффузной срединной глиомы. Примечательно, что in vitro потенция ONC206 оказалась в 10 раз сильнее, чем у ONC201 [статья]. Активация митохондриальной протеазы ClpP имипридоновыми соединениями (ONC201, ONC206, ONC212) в сочетании с ингибиторами HDAC повышает выживаемость [статья].
Оригинал статьи здесь.
После лечения первого пациента с диффузной срединной глиомой с мутацией H3K27M препаратом ONC201 (NCT02525692) был начат протокол расширенного набора пациентов. Впоследствии в него были включены 18 пациентов с H3K27M-мутированной диффузной срединной глиомой (DMG), либо диффузной внутренней глиомой моста (DIPG). Исследователи сообщили об "улучшении по МРТ" либо полном ответе на лечение глиомы таламуса и области моста, а также об улучшении неврологической симптоматики [статья]. Клиническое исследование ONC201 фазы 1 в лечении H3K27 M-мутантной DMG (NCT03416530), опубликованное в 2022 году, было направлено на оценку терапевтического эффекта ONC201 путем анализа свободной опухолевой ДНК в серийных образцах люмбальной пункции и образцах плазмы. Исследование показало, что свободная от клеток опухолевая ДНК в плазме и спинномозговой жидкости (СМЖ) может предсказать ответ на лечение ONC201 и прогрессирование заболевания у пациентов с ДМГ [статья].
Кроме того, Изабель Арриллага-Романи и др. провели лечение с помощью ONC201 - 6 взрослых пациентов с рецидивирующими глиобластомами и 20 пациентов с рецидивирующими
глиобластомами, которым не была проведена хирургическая резекция опухоли. Исследование показало, что ONC201 может быть биологически активен у пациентов с рецидивирующей глиобластомой и хорошо переносится. Мультифокальная H3K27M-мутантная глиобластома у взрослого пациента, получавшего ONC201, продемонстрировала значительный рентгенографический ответ [статья]. Потенциально, это дает основания для применения ONC201 в лечении H3K27 M-мутантных диффузных срединных глиом.
Недавнее клиническое исследование продемонстрировало эффективность ONC201 у 71 пациента с DMG с мутацией H3K27 M, что привело к значительному увеличению общей выживаемости (overall survival, OS). Медиана общей выживаемости (median OS) пациентов, получавших лечение ONC201 в первой линии, составила 21,7 месяца, что на 9,7 месяца выше исторических показателей. Кроме того, почти треть пациентов прожила более 2 лет [статья].
Для повышения эффективности и безопасности лечения диффузных срединных глиом было создано второе поколение имидазольных препаратов, включая ONC206 и ONC212. И ONC201, и ONC206 могут напрямую связываться с белком ClpP. В исследовании 2022 года сравнивалась относительная эффективность ONC201 и ONC206, и было показано, что оба препарата снижают жизнеспособность клеток DMG и увеличивают время выживания PDX-моделей (клетки свежей ткани опухоли трансплантируются мыши) диффузной срединной глиомы. Примечательно, что in vitro потенция ONC206 оказалась в 10 раз сильнее, чем у ONC201 [статья]. Активация митохондриальной протеазы ClpP имипридоновыми соединениями (ONC201, ONC206, ONC212) в сочетании с ингибиторами HDAC повышает выживаемость [статья].
Оригинал статьи здесь.
HDAC ингибиторы
Ацетилирование гистонов играет важнейшую роль в экспрессии генов (процесс, в ходе которого наследственная информация от гена (последовательности нуклеотидов ДНК) преобразуется в функциональный продукт — РНК или белок), причем ацетилирование обычно ассоциируется с увеличением экспрессии генов, а деацетилирование коррелирует с уменьшением экспрессии генов [статья]. Следовательно, модуляция ацетилирования и деацетилирования гистонов служит ключевым механизмом контроля уровня экспрессии генов. За последнее десятилетие ингибиторы гистон-деацетилаз (HDACi) стали значимыми препаратами в клинических испытаниях при различных видах заболеваний [статья]. Терапевтическое воздействие HDACi при лечении опухолей обусловлено их широким противоопухолевым действием, включая индукцию дифференцировки, остановку клеточного цикла, апоптоз и ингибирование ангиогенеза [статья]. Grant L et al. обосновали комбинацию мультигистонового ингибитора деацетилаз панобиностата (panobinostat) и ингибитора протеасомы маризомиба (marizomib) как перспективный терапевтический подход с помощью серийного высокопроизводительного скрининга. Транскриптомные и метаболомные исследования выявили существенные изменения в ключевых метаболических процессах и клеточных реакциях на развернутые белки после лечения панобиностатом и маризомибом. Последующие исследования показали, что метаболические нарушения вызывают цитотоксичность, тем самым способствуя гибели опухолевых клеток [статья]. Данное исследование представляет новый вариант лечения DMG - одноагентного и комбинированного и подчеркивает целесообразность комбинированной стратегии лечения, включающей HDACi и ингибиторы протеасомы.
Кроме того, было обнаружено, что лечение Панобиностатом снижает экспрессию скаффолд-белков EBP50 и IRSp53, тем самым подавляя пролиферацию (разрастание ткани путём размножения клеток делением), миграцию и инвазию клеток DMG и усиливая апоптоз (естественный процесс программируемой гибели клеток) [статья]. Это еще раз подчеркивает потенциал HDACi в лечении рака.
Николас А и др. использовали клинически значимые модели DMG в доклинических исследованиях, чтобы выявить и подтвердить другие биомаркеры, свидетельствующие о биологическом ответе после лечения HDACi. Квизиностат (quisinostat) и ромидепсин (romidepsin) были определены как ингибиторы, эффективно сдерживающие рост опухоли in vivo [статья]. В исследовании 2022 года, посвященном комбинированному лечению с использованием митохондриальной протеазы казеин-литической пептидазы P (ClpP) и активации HDAC-ингибиторов имидиноновыми соединениями, было показано, что такой комбинированный подход значительно продлевает выживаемость мышей, выведенных из ксенотрансплантата пациента (PDX-модель), по сравнению с монотерапией [статья].
В заключение следует отметить, что разработка HDACi представляет собой перспективное направление терапии DMG, позволяющее решить проблемы, связанные с лечением диффузных срединных глиом - злокачественных новообразований, для которых в настоящее время отсутствуют эффективные терапевтические варианты.
Оригинал статьи здесь.
Кроме того, было обнаружено, что лечение Панобиностатом снижает экспрессию скаффолд-белков EBP50 и IRSp53, тем самым подавляя пролиферацию (разрастание ткани путём размножения клеток делением), миграцию и инвазию клеток DMG и усиливая апоптоз (естественный процесс программируемой гибели клеток) [статья]. Это еще раз подчеркивает потенциал HDACi в лечении рака.
Николас А и др. использовали клинически значимые модели DMG в доклинических исследованиях, чтобы выявить и подтвердить другие биомаркеры, свидетельствующие о биологическом ответе после лечения HDACi. Квизиностат (quisinostat) и ромидепсин (romidepsin) были определены как ингибиторы, эффективно сдерживающие рост опухоли in vivo [статья]. В исследовании 2022 года, посвященном комбинированному лечению с использованием митохондриальной протеазы казеин-литической пептидазы P (ClpP) и активации HDAC-ингибиторов имидиноновыми соединениями, было показано, что такой комбинированный подход значительно продлевает выживаемость мышей, выведенных из ксенотрансплантата пациента (PDX-модель), по сравнению с монотерапией [статья].
В заключение следует отметить, что разработка HDACi представляет собой перспективное направление терапии DMG, позволяющее решить проблемы, связанные с лечением диффузных срединных глиом - злокачественных новообразований, для которых в настоящее время отсутствуют эффективные терапевтические варианты.
Оригинал статьи здесь.
EZH2 ингибиторы
Как уже говорилось ранее, эпигеном подвержен различным модификациям, включающим такие процессы, как метилирование ДНК, ацетилирование гистонов, фосфорилирование гистонов, метилирование гистонов и другие посттрансляционные модификации. Мутации в ферментных системах, регулирующих эпигеном, могут приводить к возникновению ракоподобного состояния, оказывая глубокое воздействие [ссылка]. Enhancer of Zeste homolog 2 (EZH2), каталитическая субъединица гистоновой метилтрансферазы, играет ключевую роль в катализе монометилирования, диметилирования и триметилирования лизина 27 гистона H3. Эта активность вызывает гиперметилирование нижележащих генов-мишеней, что приводит к глушению генов-супрессоров опухолей и способствует опухолевой прогрессии [статья]. Примечательно, что мутация H3K27 M приводит к гипометилированию H3K27, влияя на транскрипцию генов и способствуя развитию рака. Взаимодействие между EZH2 и мутацией H3K27M способствует прогрессии опухоли [статья].
В 2020 году FDA выдало разрешение на применение таземетостата (tazemetostat), первого в мире ингибитора EZH2, для лечения неоперабельной, метастатической или местнораспространенной эпителиоидной саркомы [статья]. Файзан Мохаммад и др. из Копенгагенского университета разработали мышиную модель, в которой мутации H3K27 M усиливают развитие опухолей. Они продемонстрировали, что Polycomb Repressive Complex 2 (PRC2) необходим для пролиферации опухолей, экспрессирующих H3K27M, а также показали, что низкомолекулярный ингибитор EZH2 останавливает рост опухолевых клеток, индуцируя белок-супрессор опухоли p16Ink4a [статья]. В совокупности эти данные свидетельствуют о том, что ингибирование EZH2 может стать терапевтической стратегией для опухолей, характеризующихся мутациями H3K27M.
Оригинал статьи здесь.
В 2020 году FDA выдало разрешение на применение таземетостата (tazemetostat), первого в мире ингибитора EZH2, для лечения неоперабельной, метастатической или местнораспространенной эпителиоидной саркомы [статья]. Файзан Мохаммад и др. из Копенгагенского университета разработали мышиную модель, в которой мутации H3K27 M усиливают развитие опухолей. Они продемонстрировали, что Polycomb Repressive Complex 2 (PRC2) необходим для пролиферации опухолей, экспрессирующих H3K27M, а также показали, что низкомолекулярный ингибитор EZH2 останавливает рост опухолевых клеток, индуцируя белок-супрессор опухоли p16Ink4a [статья]. В совокупности эти данные свидетельствуют о том, что ингибирование EZH2 может стать терапевтической стратегией для опухолей, характеризующихся мутациями H3K27M.
Оригинал статьи здесь.
07
ЭТО ДРУГОЕ..
Терапия TTF (Tumour Treatment Fields)
Поля для лечения опухолей (TTFields) представляют собой неинвазивные противораковые методы лечения, использующие переменные электрические поля в диапазоне 100-300 кГц для избирательного нарушения митоза раковых клеток (митоз - вид клеточного деления, который нужен для роста и развития). TTFields непосредственно нацелены на критически важные белки в клеточном цикле, что приводит к остановке митоза и последующей гибели клеток [статья №1, статья №2, статья №3, статья №4]. Доклинические модели показывают, что помимо ингибирования пролиферации раковых клеток через нарушение митотического веретена, что приводит к задержке митоза или гибели клеток, TTFields также вмешиваются в механизмы репарации ДНК (особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в ДНК).
Кроме того, было показано, что TTFields повышают чувствительность к химиотерапии за счет увеличения проницаемости клеток и индуцирования аутофагии (дословно "самопоедание") [статья].
Сочетание Темозоломида (TMZ) с терапией TTField продемонстрировало значительное продление общей выживаемости (OS) и выживаемости без прогрессирования (PFS). В одном случае 3-летнему ребенку с диффузной срединной глиомой была проведена одновременная химиолучевая терапия с TMZ, после чего была проведена поддерживающая терапия с использованием TTFields в сочетании с TMZ. Первоначально, результаты показали плохой ответ на TTFields, но который постепенно улучшался с течением времени. Это позволяет предположить, что прекращение лечения TTFields может быть необязательным, даже при первоначальном неудовлетворительном ответе. Вместо этого следует поддерживать пациентов, чтобы повысить их приверженность к долгосрочному лечению [статья].
Оригинал статьи здесь.
Кроме того, было показано, что TTFields повышают чувствительность к химиотерапии за счет увеличения проницаемости клеток и индуцирования аутофагии (дословно "самопоедание") [статья].
Сочетание Темозоломида (TMZ) с терапией TTField продемонстрировало значительное продление общей выживаемости (OS) и выживаемости без прогрессирования (PFS). В одном случае 3-летнему ребенку с диффузной срединной глиомой была проведена одновременная химиолучевая терапия с TMZ, после чего была проведена поддерживающая терапия с использованием TTFields в сочетании с TMZ. Первоначально, результаты показали плохой ответ на TTFields, но который постепенно улучшался с течением времени. Это позволяет предположить, что прекращение лечения TTFields может быть необязательным, даже при первоначальном неудовлетворительном ответе. Вместо этого следует поддерживать пациентов, чтобы повысить их приверженность к долгосрочному лечению [статья].
Оригинал статьи здесь.
БУДУЩЕЕ
Многие методы лечения оказались неэффективными в отношении H3K27M-мутантных DMG. Учитывая, что тактика лечении зависит от диагностирования молекулярного типа опухоли, поиск точного метода определения типа опухоли имеет решающее значение. Жидкостная биопсия стала эффективным методом выявления мутаций H3K27M в спинно-мозговой жидкости [статья №1, статья №2, статья №3]. Аналогичным образом необходим мониторинг после курса лечения. Циркулирующая опухолевая ДНК (цоДНК) успешно используется для мониторинга прогрессирования заболевания при различных видах рака у взрослых, включая рак печени, легких и молочной железы, и данный вид мониторинга становится более распространенным в педиатрической практике лечения ЦНС [статья №1, статья №2, статья №3]. ЦоДНК, выделяемая опухолевыми клетками мозга, может преодолевать гематоэнцефалический барьер и попадать в спинномозговую жидкость и плазму, что имеет большое клиническое значение для диагностики заболевания и мониторинга лечения [статья]. Кроме того, цоДНК может выступать в качестве раннего биомаркера прогрессирования заболевания, потенциально обнаруживая опухолевые изменения до того, как они станут очевидными на снимках МРТ, что позволяет раньше и точнее планировать клиническое лечение [статья №1, статья №2, статья №3, статья №4].
Однако важно отметить потенциальные риски, связанные со всплеском иммунной активности после терапии, включая синдром выброса цитокинов (СВЦ) и нейротоксичность [статья №1, статья №2]. Несмотря на отсутствие определенного эффективного лечения DMG с мутацией H3K27M и общий плохой прогноз, несколько клинических испытаний показывают многообещающие ожидаемые результаты. В будущем возможен значительный прогресс в области комбинированных методов лечения DMG с мутацией H3K27M. Тем не менее, необходимо тщательно отслеживать побочные реакции и оценивать любые изменения в состоянии пациента во время лечения. С ростом знаний о DMG с мутацией H3K27M появляется оптимизм в отношении того, что результаты лечения будут улучшаться в будущем.
Однако важно отметить потенциальные риски, связанные со всплеском иммунной активности после терапии, включая синдром выброса цитокинов (СВЦ) и нейротоксичность [статья №1, статья №2]. Несмотря на отсутствие определенного эффективного лечения DMG с мутацией H3K27M и общий плохой прогноз, несколько клинических испытаний показывают многообещающие ожидаемые результаты. В будущем возможен значительный прогресс в области комбинированных методов лечения DMG с мутацией H3K27M. Тем не менее, необходимо тщательно отслеживать побочные реакции и оценивать любые изменения в состоянии пациента во время лечения. С ростом знаний о DMG с мутацией H3K27M появляется оптимизм в отношении того, что результаты лечения будут улучшаться в будущем.
ПАЛЛИАТИВНАЯ
ПОМОЩЬ
Говорит Дом с Маяком:
Мы хотим сделать так, чтобы дети в нашей стране больше не страдали от боли и одиночества, чтобы жизнь даже самых тяжелобольных пациентов была полноценной и радостной. Мы хотим сделать так, чтобы в нашей стране неизлечимо больные дети не были предметом скорби и жалости, но стали объектом любви, помощи, сострадания и... радости. Мы построили дом для этих детей, ДОМ С МАЯКОМ, и теплый свет нашего маяка даже в самый жуткий шторм приведет их к уютному очагу.
Дневной центр – это место, где дети «Дома с маяком» могут провести день в хорошей компании.
Нам важно, чтобы дети и молодые взрослые с тяжёлыми заболеваниями не были заперты дома, а жили активной жизнью – общались со сверстниками, учились, гуляли, ходили в музеи и на концерты. Дневные центры созданы для того, чтобы помочь ребятам в этом.
В стационаре «Дома с маяком» самые тяжелобольные дети и молодые взрослые получают круглосуточное медицинское сопровождение, а родителям предоставлена возможность «социальной передышки». Там же проходят традиционные развлекательные, образовательные и психологические мероприятия для семей.
Стационар рассчитан на 15 одноместных палат. На прилегающей территории — сад с игровой площадкой, приспособленной для детей на инвалидных колясках; в здании — игровые комнаты, бассейн, в котором могут плавать в том числе ребята на аппаратах искусственной вентиляции лёгких.
Мы хотим сделать так, чтобы дети в нашей стране больше не страдали от боли и одиночества, чтобы жизнь даже самых тяжелобольных пациентов была полноценной и радостной. Мы хотим сделать так, чтобы в нашей стране неизлечимо больные дети не были предметом скорби и жалости, но стали объектом любви, помощи, сострадания и... радости. Мы построили дом для этих детей, ДОМ С МАЯКОМ, и теплый свет нашего маяка даже в самый жуткий шторм приведет их к уютному очагу.
Дневной центр – это место, где дети «Дома с маяком» могут провести день в хорошей компании.
Нам важно, чтобы дети и молодые взрослые с тяжёлыми заболеваниями не были заперты дома, а жили активной жизнью – общались со сверстниками, учились, гуляли, ходили в музеи и на концерты. Дневные центры созданы для того, чтобы помочь ребятам в этом.
В стационаре «Дома с маяком» самые тяжелобольные дети и молодые взрослые получают круглосуточное медицинское сопровождение, а родителям предоставлена возможность «социальной передышки». Там же проходят традиционные развлекательные, образовательные и психологические мероприятия для семей.
Стационар рассчитан на 15 одноместных палат. На прилегающей территории — сад с игровой площадкой, приспособленной для детей на инвалидных колясках; в здании — игровые комнаты, бассейн, в котором могут плавать в том числе ребята на аппаратах искусственной вентиляции лёгких.
МИША ЯНОВИЧ

папа и мама МИЛЫ
НАСТЯ ВАСИЛЬЕВА
МЫ
ВСЯКАЯ ВСЯЧИНА
ПЭТ-КТ
Нюансы и сложности оценки ответа на терапию при лечении глиом: почему так сложно и может ли тут помочь ПЭТ? читать здесь
27 января 2025
Григориий Чиж
Григориий Чиж

Категория
Тут будет запись или новость
Февраль, 2025

ЕЩЁ ПОЛЕЗНЫЕ ШТУКИ
Искать можно на https://pubmed.ncbi.nlm.nih.gov/
Получать статьи цeликом можно через Telegram t.me/SciArticleChat
Можно искать статьи на https://www.sci-hub.wf/ , но у меня не получается!)
Получать статьи цeликом можно через Telegram t.me/SciArticleChat
Можно искать статьи на https://www.sci-hub.wf/ , но у меня не получается!)
Общая база здесь https://clinicaltrials.gov/
По DIPG список обновляется здесь https://dipg.org/treatment/clinical-trials/active-clinical-trials/
По DIPG список обновляется здесь https://dipg.org/treatment/clinical-trials/active-clinical-trials/
Можно почитать блог Boris Paskalev - https://www.swissdipg.org/blog
ЧИТАТЬ ИСТОРИИ
